通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示: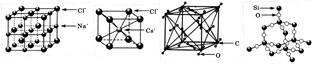
下列关于这些晶体结构和性质的叙述不正确的是( )
)
A.同一主族的元素与另一相同元素所形成的化学式相似的物质 不一定具有相同的晶体结构 不一定具有相同的晶体结构 |
| B.一个CO2晶体的最小重复结构单元中含有6个CO2分子 |
| C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 |
| D.在二氧化硅晶体中,平均每个Si原子形成4个Si—O共价单键 |
下列除杂方案错误的是
| 选项 |
被提纯的物质 |
杂质 |
除杂试剂 |
除杂方法 |
| A |
SO2 (g) |
HCl(g) |
饱和NaHSO3溶液、浓H2SO 4 |
洗气 |
| B |
NH4Cl(aq) |
Fe3+(aq) |
NaOH 溶液 |
过滤 |
| C |
Cl2(g) |
HCl(g) |
饱和食盐水、浓H2SO4 |
洗气 |
| D |
Na2CO3(s) |
NaHCO3(s) |
— |
加热 |
下列各组离子在指定溶液中关于离子共存的说法正确的是
| A.25℃时溶液中一定大量共存:Na+、Ca2+、Cl-、SO42- |
| B.能与铝反应放出氢气的溶液中一定共存:Mg2+、Cu2+、SO42-、NO3- |
| C.弱碱性溶液中可能大量共存:Na+、K+、Cl‾、HCO3‾ |
| D.0.1mol/LFeCl3溶液中可能大量共存:Fe2+、NH4+、SCN-、SO42- |
下列指定反应的离子方程式正确的是
| A.Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
D.用CuCl2溶液做导电性实验,灯泡发光:CuCl2 Cu2+ +2Cl— Cu2+ +2Cl— |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,40g SO3的体积为11.2L |
| B.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3 NA |
C.5NH4NO3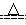 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA |
| D.56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
性质决定用途,化学知识运用得当可以使人类的生活更美好。下列物质性质与应用的对应关系正确的是
| A.晶体硅熔点高硬度大,可用于制作半导体材料 |
| B.浓硫酸具有酸性,可用于刻蚀玻璃制品 |
| C.漂白粉在空气中不稳定,可用于漂白纸张 |
| D.氢氧化铝具有弱碱性,可用于制胃酸中和剂 |