元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)第VIA族元素形成的氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
| 氢化物 |
A |
B |
HF |
D |
E |
| 沸点/℃ |
1317 |
100 |
19.5 |
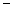 33.35 33.35 |
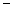 164 164 |
(3)第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。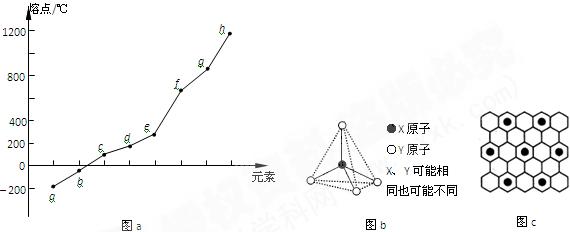
A、B、C、D、E均为可溶于水的固体,组成它们的离子有:
| 阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 |
OH- Cl- 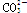 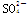 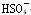 |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减小,但不消失。
据此推断它们是:
A____________;B____________;C____________; D____________;E____________。
有A、B、C、D、E、F、G 7瓶不同物质的溶液,它们分别是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如下表所示。表中“↓”表示生成沉淀或微溶化合物,“—”表示观察不到明显变化。试回答下列问题。
| A |
B |
C |
D |
E |
F |
G |
|
| A |
— |
— |
— |
— |
— |
— |
↓ |
| B |
— |
— |
— |
— |
↓ |
↓ |
↓ |
| C |
— |
— |
— |
↓ |
— |
↓ |
↓ |
| D |
— |
— |
↓ |
— |
↓ |
↓ |
↓ |
| E |
— |
↓ |
— |
↓ |
— |
↓ |
— |
| F |
— |
↓ |
↓ |
↓ |
↓ |
— |
↓ |
| G |
↓ |
↓ |
↓ |
↓ |
— |
↓ |
— |
(1)A的化学式是________,G的化学式是________,判断理由是
___________________________________________________。
(2)写出其余几种物质的化学式:B:________,C:________,D:________,E:________,F:________。
有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠。现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。
请填写下列空白:
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管,观察到的现象是________________________________________________________________________
________________________________________________________________________。
被检出的物质的化学式(分子式)是________。
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式是
________________________________________________________________________
________________________________________________________________________。
被检出的物质的化学式(分子式)是________。
(3)鉴别余下未检出物质的方法和观察到的现象是
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 |
Ag+ |
Ba2+ |
Al3+ |
| 阴离子 |
OH- |
Cl- |
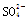 |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀;
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
(1)写出化合物的化学式:A__________,C__________,D__________,E__________。
(2)A溶液与过量E溶液反应后,最终得到的沉淀的化学式是________。
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示: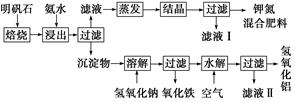
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有251.28 g氨)__________mL,用规格为__________mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、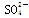 外,还有大量的
外,还有大量的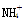 。检验
。检验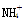 的方法是________________________________________________________________________
的方法是________________________________________________________________________
________________________________________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________________________________________。
(4)滤液Ⅰ的成分是水和______________________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为__________mol(用含有m、n的代数式表示)。