现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 |
Ag+ |
Ba2+ |
Al3+ |
| 阴离子 |
OH- |
Cl- |
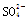 |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀;
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
(1)写出化合物的化学式:A__________,C__________,D__________,E__________。
(2)A溶液与过量E溶液反应后,最终得到的沉淀的化学式是________。
完成以下化学方程式
(1)____S+____KOH===____K2S+____K2SO3+____H2O
(2) KMnO4 + HBr= Br2 + MnBr2 + KBr + H2O
完成下列反应的反应方程式:
(1)NaOH溶液吸收氯气的反应:____________________________
(2)铁与水蒸气在高温下的反应: ____________________________
(3)氢氧化铁溶于盐酸:____________________________
(4)铝单质溶解在氢氧化钠溶液中:____________________________
(5)过氧化钠与二氧化碳反应:____________________________
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1)氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板_________________________。
(2)吸收剂X的化学式为 ;氧化剂Y的化学式为____________。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_____ 。
(5)K2FeO4在水溶液中易发生反应:4FeO42+10H2O 4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
| A.H2O |
| B.稀KOH溶液、异丙醇 |
| C.NH4Cl溶液、异丙醇 |
| D.Fe(NO3)3溶液、异丙醇 |
(6)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O CrO42-+Fe(OH)3↓+OH-
CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
③Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。
(每空2分,共10分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)
| 阳离子 |
H+ Na+ Al3+ Ag+ Ba2+ |
| 阴离子 |
OH- Cl- CO32- NO3- SO42- |
已知:
| 阳离子 |
H+、Na+、Al3+、Ag+、 Ba2+ |
| 阴离子 |
OH-、 Cl-、CO32-、NO3-、SO42- |
① A、B两溶液呈碱性;C、D、E溶液呈酸性。
② A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③ D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)分别写出A、E的化学式:A 、E
(2)写出A与E反应的离子方程式: ;
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H =-Q kJ·mol-1。写出B与C稀溶液反应的热化学方程式 。
(4)在100 mL 0.1 mol·L-1 E溶液中,逐滴加入40 mL 1.6 mol·L-1 NaOH溶液,最终得到沉淀物质的量为_____ mol。
(每空1分,共11分)从下列各组反应对比,判断那种微粒的氧化性最强。
(1)铁钉浸入硫酸铜溶液中后,表面会附有红色物质,铜丝浸入硝酸银溶液后,表面会附有银白色物质。则铜、铁、银中,_____ ___原子的还原性最强;Cu2+、Ag+、Fe2+中, 离子的氧化性最强。
(2)在氯气中Fe锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液FeCl2。则氯气分子、氢离子、氯离子中, 具有氧化性, 氧化性最强。请书写出以上各反应的化学方程式________ 、 。
(3)已知在ⅣA族元素中,Pb2+和Sn4+的化合物较为稳定。
①据此可判断PbO2具有较强的________性,SnCl2具有较强的 性;写出PbO2溶于盐酸的离子方程式__________;写出SnCl2和FeCl3溶液混合的离子方程式__________ ;
②PbO2、Fe3+、Cl2、Sn4+氧化性由强到弱的顺序是__________ 。