已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+= Fe3++Ce3+ Sn2++2Fe3+ = 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是:( )
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、Ce3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe3+、Sn2+、Ce3+ |
某元素同位素的单质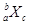 ,极易形成
,极易形成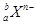 ,下列说法不正确的是( )
,下列说法不正确的是( )
| A.此气体分子中含有的中子数为b-a |
| B.此元素的离子中含有的电子数为a+n |
| C.此气体分子中含有的质子数为c(a+n) |
D.一个该同位素原子的质量约为 g g |
H2A是二元弱酸,KHA溶液呈酸性。在0.1mol·L-1 KHA溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c(HA-)+c(OH-)+c(A2-) B.c(HA-)+c(A2-)=0.1mol·L-1
C.c(A2-)>c(H2A) D.c(K+)=c(H2A)+c(HA-)+c(A2-)
已知E与G反应生成L和M,且组成E、G、L、M分子的元素原子序数均小于10,用它们的结构式表示反应如下图所示。则下列判断错误的是( ) +
+ 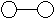
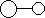 +
+ 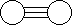
E G L M
| A.G是最活泼的非金属单质 | B.L分子中有共价键 |
| C.E能使紫色石蕊试液变蓝色 | D.M化学性质很活泼 |
下列叙述中,正确的是( )
| A.浓硫酸能将炽热的木炭氧化为二氧化碳 |
| B.稀硫酸能按水的组成比脱去蔗糖中的氢、氧元素 |
| C.硫酸和硝酸分别与金属反应时,S和N元素的化合价一定发生变化 |
| D.因为浓硫酸或浓硝酸能与铝反应,所以常温下二者都不能用铝制容器盛装 |
用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是( )
A.Cu Cu(NO3)2 Cu(NO3)2 |
B.Cu Cu(NO3)2 Cu(NO3)2 |
C.Cu CuCl2 CuCl2 Cu(NO3)2 Cu(NO3)2 |
D.Cu CuO CuO Cu(NO3)2 Cu(NO3)2 |