抗击“非典”期间,过氧乙酸(CH3COOOH)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
①□MnO4-+□H2O2+□H+ =□Mn2++□O2↑十□H2O
②H2O2+2 +2H+ =I2+2H2O
+2H+ =I2+2H2O
③CH3COOOH+2 +2H+= CH3COOH+I2+H2O
+2H+= CH3COOH+I2+H2O
④I2+ 2S2O32- =2I-+ S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填入以下方框内):
□MnO4-+□H2O2+□H+ =□Mn2++□O2↑十□H2O
(2)用单线桥法在下面已配平的化学方程式上标出电子转移的方向和数目:
□MnO4-+□H2O2+□H+ =□Mn2++□O2↑十□H2O
(3)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(4)取b0L待测液,用硫酸使溶液酸化,再用浓度为a1 mol· 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2mol· 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol·
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol· 。
。
(5)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 ________(填是或否)
设NA为阿伏加德罗常数,下列说法正确的是
| A.58.5 g氯化钠中约含有6.02×1023个氯化钠分子 |
| B.常温常压下,2.24LC2H4中含有共用电子对的数目为0.6NA |
| C.0.1molNa2O2与足量的水反应,转移电子数为0.2NA |
| D.200mL 0.5 mol·L-1的Na2CO3溶液中阴离子数目大于0.1 NA |
下列有关说法正确的是
| A.乙烯和苯都能与溴水反应 |
| B.用饱和Na2CO3溶液可以将乙醇和乙酸鉴别开来 |
| C.葡萄糖和淀粉在一定条件下都能发生水解反应 |
| D.苯不能使KMnO4溶液褪色,所以苯不能发生氧化反应 |
.短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
| A.元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
| B.元素X与氢形成的原子比为1:1的化合物有很多种 |
| C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| D.元素Z可与元素X形成共价化合物XZ2 |
在pH为4-5的环境中,Cu2+和Fe2+不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右。在慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去所得CuCl2溶液中的杂质离子,下列方法中可行的是
| A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5 |
| B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5 |
| C.向溶液中通入Cl2,在通入NH3调节至pH4-5 |
| D.向溶液中通入H2O2, 再加入CuO粉末调节至pH4-5 |
下表为短周期元素①~⑧的部分性质。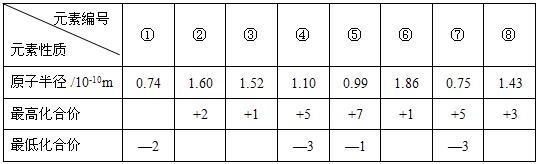
下列说法正确的是
| A.元素④⑤形成的化合物是离子化合物 |
| B.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强 |
| C.元素①⑥⑧形成的化合物具有两性 |
| D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强 |