设NA为阿伏加德罗常数,下列说法正确的是
| A.58.5 g氯化钠中约含有6.02×1023个氯化钠分子 |
| B.常温常压下,2.24LC2H4中含有共用电子对的数目为0.6NA |
| C.0.1molNa2O2与足量的水反应,转移电子数为0.2NA |
| D.200mL 0.5 mol·L-1的Na2CO3溶液中阴离子数目大于0.1 NA |
下列热化学方程式中ΔH代表燃烧热(25℃,101 kPa)的是( )
A.CH4(g)+ O2(g) O2(g) 2H2O(l)+CO(g)ΔH1 2H2O(l)+CO(g)ΔH1 |
B.S(s)+ O2(g) O2(g) SO3(s)ΔH2 SO3(s)ΔH2 |
C.C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)ΔH3 6CO2(g)+6H2O(l)ΔH3 |
D.2CO(g)+O2(g) 2CO2(g)ΔH4 2CO2(g)ΔH4 |
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。 向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是()。
A. |
B.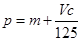 |
| C.n=m+0.017Vc | D.n=p+ ×2 ×2 |
将NO2、NH3、O2混合气22.4L通过稀硫酸后,溶液质量增加了26.7g,气体体积缩小为4.48L。(气体体积均在标况下测定)剩余气体能使带火星的木条着火,则混合气体的平均相对分子质量为(4NO2+O2+2H2O=4HNO3)( )
| A.28.1 | B.30.2 | C.33.1 | D.34.0 |
把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后,再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
| A.盐酸的体积为80mL | B.a的取值范围为0<a<50 |
| C.n(Mg2+)<0.025mol | D.当a值为30时,b值为0.01 |
将15.6g Na2O2和5.4g Al同时放入一定量的水中充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是( )
| A.最终得到7.8g的沉淀 |
| B.反应过程中得到6.72L(标准状况)的气体 |
| C.最终得到的溶液中c(NaCl)=2.0mo/L |
| D.最终得到的溶液中Al元素都以Al(OH)3形式存在 |