一定条件下,对可逆反应X(g)+2Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.2 mol/L、0.06 mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.2 mol/L、0.06 mol/L,则下列判断不合理的是
| A.c1∶c2= 1∶3 | B.X和Y的转化率相等 |
| C.平衡时,X和Z的生成速率之比为1∶2 | D.c1的取值范围为0<c1<0.13 |
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A.28g氮气所含有的原子数目为NA |
| B.4g金属钙变成钙离子时失去的电子数目为0.1NA |
| C.1mol甲烷的质量与NA个甲烷分子的质量之和相等 |
| D.标准状况下,22.4L甲烷和乙炔混合物所含的分子数为NA |
设NA为阿伏加德罗常数,下列说法不正确的是( )
| A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA |
| B.18g H2O中含有的电子数为10NA |
| C.46g二氧化氮和46g四氧化二氮含有的原子数均为3NA |
| D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA |
NA代表阿伏加德罗常数,以下说法正确的是( )
| A.氯化氢气体的摩尔质量等于NA氯气分子和NA个氢分子质量之和 |
| B.常温常压下1molNO2气体与水反应生成NA个NO3-离子 |
| C.121g CCl2F2所含氯原子数为2NA |
| D.62gNa2O溶于水后所得溶液中含有O2-离子数为NA |
已知一定温度下合成氨反应: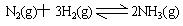 ;△H=—92.4kJ·mol—1。在相同温度、相同体积的密闭容器中进行如下实验:①通入1molN2和3molH2达平衡时放出热量为Q1;②通入2molN2和6molH2,达平衡时放出热量为Q2,则下列关系正确的是( )
;△H=—92.4kJ·mol—1。在相同温度、相同体积的密闭容器中进行如下实验:①通入1molN2和3molH2达平衡时放出热量为Q1;②通入2molN2和6molH2,达平衡时放出热量为Q2,则下列关系正确的是( )
| A.Q2=2Q1 |
B.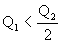 |
| C.Q1<Q2<184.8kJ |
| D.Q1=Q2<92.4kJ |
100 mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度为( )
| A.0.20mol/L |
| B.0.25mol/L |
| C.0.40mol/L |
| D.0.50mol/L |