有下列三个反应:①C12+FeI2= FeC12+I2 ②2Fe2++Br2= 2Fe3++2Br—
③Co2O3+6HC1 = 2CoC12 + Cl2↑+3H2O,下列说法正确的是( )
| A.①②③中氧化产物分别是FeC12、Fe3+、C12 |
| B.根据以上方程式可以得到氧化性C12>Co2O3>Fe3+ |
| C.在反应③中生成1molCl2时,有2molHC1被氧化 |
| D.根据反应①②一定可以推理得到C12+FeBr2= FeC12+Br2 |
从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:
HIn(溶液,红色) H+(溶液,无色)+In-(溶液,黄色)而用作酸碱指示剂。往该溶液中加入足量Na2O2粉末,则最终溶液颜色为
H+(溶液,无色)+In-(溶液,黄色)而用作酸碱指示剂。往该溶液中加入足量Na2O2粉末,则最终溶液颜色为
| A.红色变深 | B.黄色变浅 | C.黄色变深 | D.褪为无色 |
在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g) + nB(g) 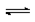 pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
| A.A的百分含量不再改变 |
| B.各组分的浓度不再改变 |
| C.反应速率υA : υB : υC : υD =" m" : n : p : q |
| D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
已知:H2(g)+F2(g) =2HF(g) △H=-270kJ/mol,下列说法正确的是
| A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ |
| B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ |
| C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 |
| D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量 |
已知在450℃时,反应H2(g)+I2(g)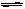 2HI(g)的K为50,由此推断出在450℃时,反应2HI(g)
2HI(g)的K为50,由此推断出在450℃时,反应2HI(g)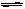 H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
| A.50 | B.0.02 | C.100 | D.无法确定 |
把下列四种 X 溶液分别加入四个盛有 10mL2 mol•L-1盐酸的烧杯中,均匀加水稀释到50mL。此时X 和盐酸进行反应。其中反应速率最大的是
| A.40mL 1.5 mol•L-1的 X 溶液 | B.20mL 2 mol•L-1的X 溶液 |
| C.10mL 4 mol•L-1的X 溶液 | D.l0mL 2 mol•L-1的X 溶液 |