 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g) 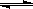 CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
② CO(g)+2H2(g) 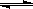 CH3OH(g) △H2
CH3OH(g) △H2
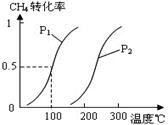
将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
(1)温度不变,缩小体积,增大压强,①的反应速率 (填“增大”、“减小”或“不变”),平衡向 方向移动。
(2)反应①的△H1 0(填“<”、“=”或“>”),其平衡常数表达式为K= ,100℃时的平衡常数值是 。
(3)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下进行反应②生成甲醇。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
| 实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
| I |
150 |
1/3 |
0.1 |
| II |
|
|
5 |
| III |
350 |
|
5 |
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。a:T 100℃(填“大于”“小于”),判断理由是 。
b:列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
[化学——物质结构与性质]尿素 可用于制有机铁肥,主要代表有
可用于制有机铁肥,主要代表有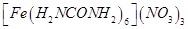 [三硝酸六尿素合铁(III)]。
[三硝酸六尿素合铁(III)]。
(1)基态Fe3+的核外电子排布式为__________。C、N、O三种元素的第一电离能由大到小的顺序是__________。
(2)尿素分子中C、N原子的杂化方式分别是___________。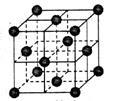
(3) 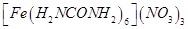 中“
中“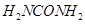 ”与Fe(III)之间的作用力是___________。与
”与Fe(III)之间的作用力是___________。与 互为等电子体的一种化合物是___________(写化学式)。
互为等电子体的一种化合物是___________(写化学式)。
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有__________个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比是___________。
甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H=Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________________________________。
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3mol,则理论上生成的SO42-为________mol。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
(4)写出甲中通入甲醇这一极的电极反应式________________________________。
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中NaCl的物质的量浓度为________mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_______g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_____克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.工业设计生产NaClO2的主要流程如下: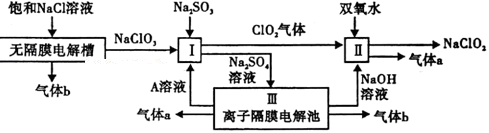
(1)A的化学式是 ,装置Ⅲ中A在 极区产生.
(2)Ⅱ中反应的离子方程式是
(3)通电电解前,检验Ⅲ中阴离子的方法和步骤是
(4)为防止Ⅱ中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是
(填字母编号).
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07×10-2 mol·L-1,Ⅱ中反应所得NaClO2
溶液(含少量NaOH)的pH=13,则溶液中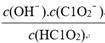 =
=
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200mL0.5mol·L-1的CuSO4溶液,生成铜3.2g,此时所得溶液中离子浓度由大到小的顺序是
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)ΔH2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l)ΔH= 。(请用含有ΔH1、ΔH2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度/K |
平衡时NH3的物质的量/mol |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(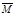 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明一段时间后该可逆反应达到了平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明一段时间后该可逆反应达到了平衡状态的是 。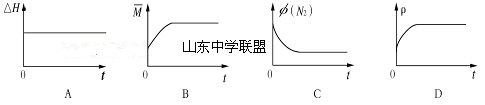
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。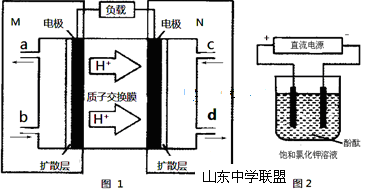
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。