已知A、B为气体单质,其中一种为黄绿色;D为常见金属单质,
C为化合物,它们之间有下列转化关系: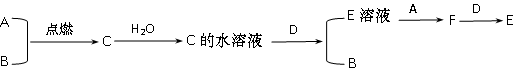
(1)试写出A、B、C、D的化学式:
A ;B ;C ;D 。
(2)写出C的水溶液与D反应的离子反应方程式: 。
(3)F与D反应的离子反应方程 式: ____ 。
(4)检验F中阳离子的试剂可以用: ___________ ____ ,
现象: _____________________ 。
(10分)有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D元素与B元素的质量比为7:8;E元素与B元素的质量比为1:1。试回答:
(1)写出D原子的电子排布式____________________。
(2)用电子式表示AE2的形成过程________________________________________。
(3)B、C两元素的第一电离能较大的元素是:________(填写元素符号)。
(4)C的氢化物的VSEPR模型为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为:________>________(填写化学式)。
(6)由元素D组成的单质晶体中,与某个D原子距离最近的D原子有_____个;1molD的氧化物晶体中,含D-O键的数目____________。
本题由两小题构成,共16分。
Ⅰ、(8分)A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族。B、C、D的最高价氧化物对应水化物均能互相发生反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示。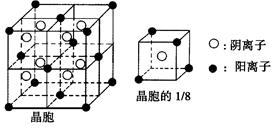
(1)A和E所形成化合物的电子式是__________。
(2)A、B、C、D四各元素的原子半径由小到大的顺序为__________(用元素符号表示)。
(3)A和E形成的化合物的晶体中,每个阳离子周围与它最近且距离相等的阳离子共有_________个。
(4)已知A和E所形成化合物晶体的晶胞体积为1.6×10-22 cm3,则A和E组成的离子化合物的密度为(结果保留一位小数)__________。
Ⅱ.(8分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上有2对成对电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有________种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是________。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式________(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z原子的价电子数比T原子多
e.Z的最高价氧化物的水化物酸性强于T的最高价氧化物的水化物
f.Z的单质能与T的氢化物水溶液发生置换反应
(4)Z有多种常见含氧酸,酸性由强到弱的顺序是________________________。
(14分)今有aX、bY、cZ三种元素。
已知:
①各原子序数a、b、c均小于20,且a+b+c=25;
②元素Y的原子外围电子构型为ns2npn+2;
③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;
④Z的硫化物的相对分子质量与Z氯化物的相对分子质量之比为38:77。
据上可推知,
(1)X、Y、Z三种元素形成的常见化合物的化学式是_________________。
(2)X2Y2是________晶体(填晶体类型),构成晶体的微粒是________(填微粒符号) ,该晶体中微粒间的作用有__________________________________。
(3)Z的硫化物和氯化物的分子空间构型分别是____________、__________,其中Z原子分别以______杂化轨道成键,根据成键方式分类,Z的硫化物分子中含有的键的种类及其数目是______________。
(4)Z的氢化物种类很多,写出Z的氢化物分子中所有原子都在同一平面上的任意两种简单的化合物的名称_________、__________。
(11分)下图是元素周期表的一部分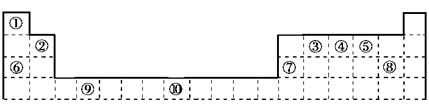
(1)写出元素⑩的基态原子的电子排布简化式________,外围电子排布图________________。指出它在周期表中的位置________。焊接钢轨时,常利用⑩的某些氧化物与⑦的单质在高温下发生反应,试写出其中一条反应的化学方程式_____________________________。
(2)①③⑤三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的电子式________,推测该分子的空间构型为________。
(3)③④⑤⑥⑧五种元素都可以与元素①形成化合物,其中熔点最高的是________(写化合物的化学式)。如果在温度接近373 K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果总是比理论值高,其原因是___________________________________________。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式___________________________。
(14分,每空2分)有A、B、C、D 4种烃,各取0.01 mol充分燃烧后,B、C、D所产生的二氧化碳均为448 mL(标准状况);A燃烧所得的二氧化碳是其他三者的3倍。在镍催化剂的作用下,A、B、C都能和氢气发生加成反应,B可以转变为C或D,C可以转变为D;B或C都能使酸性高锰酸钾溶液褪色,而A、D无此性质;在FeBr3存在时,A与溴发生取代反应。
试推断出4种烃的结构简式:
(1)A是_______________,B是______________,C是______________,D是________________。
(2)B→D的反应方程式:_____________________________________________。
(3)除去D中C的反应方程式:______________________________________。
(4)C发生加聚反应的方程式:________________________________________。