(15分) A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大。A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1 ="578" kJ/mol,I2="1" 817 kJ/mol,I3=" 2" 745 kJ/mol,I4 ="11" 575 kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34。请回答下列问题:
(1)AY2是一种常用的溶剂,为 分子(填“极性”或“非极性”),分子中存在 个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为 超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于 晶体。B的最简单氢化物容易液化,理由是 。
(3)X、氧、B元素的电负性由大到小的顺序为 (用元素符号作答) 。
(4)Z的基态原子核外电子排布式为 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是 (填序号)
①氧化剂是O2
②HO2在碱中不能稳定存在
③氧化产物是HO2
④1 mol Z参加反应有1 mol电子发生转移
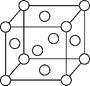
(5)已知Z的晶胞结构如下图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 cm。ZYO4常作电镀液,其中YO42-的空间构型是 ,Y原子的杂化轨道类型是 杂化。
如图甲、乙是电化学实验装置。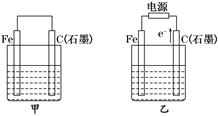
(1)若甲、乙两烧杯中均盛有NaCl溶液.
①甲中石墨棒上的电极反应式为____________________________________________。
②乙中总反应的离子方程式为______________________________________________。
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为__________________________________________________________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液.
①甲中铁棒上的电极反应式为____________________________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________ g。
(10分)甲、乙两位学生分别对淀粉的水解情况进行了探究实验。
【提出假设】淀粉在一定条件下可以水解
【实验过程】学生甲在一支试管中放入0.5 g淀粉后,再加入质量分数为20%的硫酸溶液,加热10 min后,再将溶液一分为二,其中一份溶液做银镜反应实验,结果无银镜出现,另一份溶液加入碘水,结果无蓝色出现;学生乙在一支试管中放入0.5 g淀粉后,再加入质量分数为20%的硫酸溶液少许,加热45 min后,加入过量的NaOH溶液中和硫酸,再将溶液一分为二,其中一份溶液做银镜反应实验,结果有银镜产生,另一份溶液中加入少量碘水,未出现蓝色。
【实验分析】(1)淀粉水解的过程中发生的化学反应是:
_________________________________________________________________________。
(2)学生甲的实验操作不正确的地方是__________________________________________。
根据甲的实验现象,淀粉的水解情况是_________________。
A.完全水解 B.部分水解 C.没有水解 D.不能准确判断
(3)学生乙的实验操作不正确的地方是__________________________________________。
根据乙的实验现象,淀粉的水解情况是________________。
A.完全水解 B.部分水解 C.没有水解 D.不能准确判断
(10分)普通玻璃是 (混合物、纯净物)玻璃可在一定温度范围内软化,制成工艺品等。这是因为玻璃是一种物质,没有固定的 。盛强碱溶液的磨口试剂瓶都不能用玻璃瓶塞的原因是
。
变色眼镜的玻璃片中含有少量的溴化银和微量氧化铜。当玻璃受到阳光照射时,因为发生反应(用化学方程式表示),而使玻璃由无色变为暗棕色。
(6分) A、B两种溶液,一种是植物油,一种是矿物油。现各取少量,放在两只洁净的试管里,加入NaOH溶液并加热,冷却后加水振荡,A出现泡沫,B无明显现象。由此可推出:A为________________,B为________________;理由是____________________________________________________________________________________________________________________________________________________。
金属的腐蚀是指。
由于与金属接触的介质不同,发生腐蚀的化学原理也不同,一般可分为
和,其中更为普遍。