氮和硫的化合物对大气都有严重污染,据所学化学反应原理回答下列问题:
(1)NO2与悬浮在大气中海盐粒子的相互作用时发生反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) ∆H =" a" KJ/mol
NaNO3(s)+ClNO(g) ∆H =" a" KJ/mol
则该反应为 反应(填放热或吸热),产物ClNO的结构式为 。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)若将SO2,NO2,O2按4:4:3通入水中充分反应,写出总的离子方程式 。
(4)向氨水中通入过量的H2S,所得溶液M中溶质的电子式为 ;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是 ,此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka= (提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)
按下列化学反应基本类型依次填入四个化学方程式,要求后一个反应的反应物必须含有前一个反应的生成物:
(1)分解反应: 。
。
(2)置换反应:。
(3)化合反应:。
(1)某电解质溶液中,可能大量存在有Ag+、H+、CU2+、CO32-、OH-、Cl-离子,你认为一定有的离子是,一定没有的离子是;
(2)铜、铁、锌等质量合成的合金Wg,加入FeCl3和盐酸的混合液中,充分反应后:
①若无固体剩余,则溶液中的阳离子一定大量存在的 是。
是。
②若剩余固体为W/3g,则溶液中的阳离子一定大量存在的是 。
。
过量铁粉与稀硝酸反应的方程式为:
Fe+HNO3(稀)→Fe(NO3)2+NO↑+H2O
(1)请写出上述反应配平的离子方程式;
(2)标准状况下,当生成2.24L NO气体时,转移电子的物质的量为,有mol氧化剂被还原。
试回答下列问题:
(1) 已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为。
已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为。
(2)把1 molNa和1mol Mg分别投入到过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为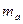
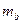
(3)右图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答
下列问题: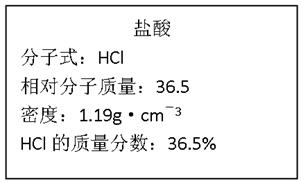
①该浓盐酸中HCl的物质的量浓度为mol/L。
②标准状况下,1.00L水(密度:1.00g·cm-3)吸收L的HCl可制得上述浓盐酸。
写出下列反应的离子方程式
(1)铜与浓硝酸溶液反应
(2)碳酸氢铵溶 液中加入过量氢氧化钠溶液
液中加入过量氢氧化钠溶液
(3)向Ba(OH)2溶液中,逐滴加入过量的NaHSO4溶液至中性,