现代循环经济要求综合考虑环境污染和经济效益。请填写下列空白。
(1)实验室里,可用于吸收SO2尾气的一种试剂是 。
(2)高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、 FeO、SiO2)为原料制备高纯氧化铁(软磁α- Fe2O3)的生产流程示意图:
①步骤I中过滤所得滤渣的主要成分是 。
②步骤II中加入铁粉的目的是 。
③步骤Ⅲ中可选用 试剂调节溶液的pH(填标号)。
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
④写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式 。
⑤从滤液C中回收的主要物质的一种用途是 。
为了测定足量铜与适量一定浓度的浓硝酸反应生成一氧化氮气体和二氧化氮气体的物质的量之比(用m表示),请从下图中选用合适的实验装置,设计一个合理而简单的实验,用于测定m的值。(不考虑二氧化氮转化为四氧化二氮)其中E装置为量气管,由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0~50mL),供量气用,乙管可上下移动,用来调节液面高低。回答下列问题:
(1)装置的连接顺序是 。(填各接口的编号)。
(2)连接好装置并检查气密性后,应打开 通入氮气;然后打开____,从乙管注水至充满甲、乙两管,关上a、b。通入氮气的原因是 。
(3)实验后,若量气管中气体的体积为VmL(已换算成标准状况下),要测定m的值,还要将____中的溶液做________实验,假设测得其中溶质物质的量为n,用含V和n的式子表示:m= (答案要求化简)。
(4)下列操作中能造成m值偏小的是_ 。
| A.反应前E中甲管所装水里气泡没赶尽,而最后读数时气泡消失 |
| B.实验后未冷却至室温即开始读数 |
| C.实验前没有先通入足量的氮气 |
| D.实验过程中,E装置乙管的水溢出 |
)高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
(1)工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品, ,搅拌。
② 。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3, ,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(2)Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)。
选做[实验化学]甲苯氧化法制备苯甲酸的反应原理如下: + 2KMnO4
+ 2KMnO4
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O + HCl
+ HCl
 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。

(1)实验室中实现操作Ⅰ所需的玻璃仪器有 、烧杯;操作Ⅱ的名称为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 。
(3)在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是 ;如图2所示抽滤完毕,应先断开 之间的橡皮管。
(4)纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸质量分数为 。
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。Ⅰ、实验室制取的方法之一是:Ca(OH)2 +2HCHO + H2O2 = Ca(HCOO)2 + 2H2O + H2↑。
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)过氧化氢比理论用量稍多,其目的是 。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是 。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 。
(4)实验时需强力搅拌45min,其目的是 ;结束后需调节溶液的pH 7~8,其目的是 。最后经结晶分离、干燥得产品。
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算),现提供的试剂有:a.甲酸钠,b.5mol·L-1硝酸,c. 5mol·L-1盐酸,d. 5mol·L-1硫酸,e. 3%H2O2溶液,f.澄清石灰水。
请补充完整由碳酸钙制备甲酸钙的实验步骤
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Al3+ |
3. 0 |
5. 0 |
| Fe2+ |
5. 8 |
8. 8 |
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶待用,并称取研细的碳酸钙样品10g待用。
步骤2. 。
步骤3. 。
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、 、洗涤、60℃时干燥得甲酸钙晶体。
某科研小组以难溶性钾长石(K2O•Al2O3•6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下: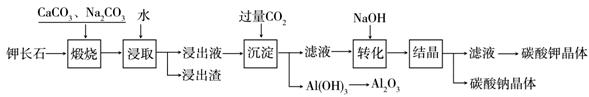
(1)煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式是: 。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O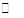 Al(OH)3 + OH— ,
Al(OH)3 + OH— ,
“浸取”时应保持溶液呈 性(填“酸”或“碱”)。
(3)“转化”时加入NaOH的主要作用是 (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是 、 和水。
(5)以Al2O3为原料,以石墨为电极,通过电解法可制得金属铝。电解池中接电源负极的一极的电极反应式是 。长时间电解后,需要更换新的石墨电极的是 极(填“阴”或“阳”)。