50 g浓度为c mol·L一,密度为ρg·cm一3的氨水中加入一定量的水稀释成0.5c mol·L一,则加入水的体积应 ( )
| A.小于50 ml | B.等于50 ml |
| C.大于50 ml | D.等于50/ρ ml |
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的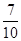 ,则下列说法中不正确的是()
,则下列说法中不正确的是()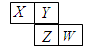
| A.最高价氧化物对应水化物的酸性:W > Z |
| B.Y元素的两种同素异形体在常温下都是气体 |
| C.原子半径由大到小排列顺序:Z >Y >X |
| D.气态氢化物的稳定性:Y > X |
元素周期表里金属元素和非金属元素分界线附近能找到()
| A.制农药元素 | B.制催化剂元素 |
| C.制半导体元素 | D.制耐高温合金元素 |
两份铝屑,一份与过量HCl反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为()
| A.1:2 | B.1:1 | C.1:3 | D.2:1 |
下列反应的离子方程式正确的是()
A.石英与烧碱溶液共热:SiO2 + 2OH- SiO32-+ H2O SiO32-+ H2O |
| B.在氯化铝溶液中滴加过量的氨水:Al3++ 4 OH-=[Al (OH)4]- |
| C.在氢氧化钠溶液中通入过量的CO2:2OH-+ CO2 = CO32-+ H2O |
| D.将铜加入稀盐酸中:Cu+2H+= Cu2+ + H2↑ |
原子核里一定含有的微粒是()
| A.质子 | B.质子和电子 | C.质子和中子 | D.电子 |