A、B、C、D均为中学化学常见的纯净物,它们之间有如下转化关系(某些生成物已略去) 试回答:
试回答:
(1)若A是非金属元素形成的化合物,且A与B、C在一定条件下都能反应生成一种无毒的气体。请写出下列化学方程式
①C→D ;
②A和C反应 。
(2)若A是金属单质。
①向AlCl3 溶液中滴加D的水溶液,能看到的现象是,理
溶液中滴加D的水溶液,能看到的现象是,理
由是(用离子方程式表示)____________________;
②继续向所得溶液中通入足量的CO2气体,可看到的现象是,
写出反应的离子方程式。
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)C元素在周期表中的位置。
(2)A元素与水反应的离子方程式是 。
。
(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式 。
。
(4)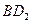 和
和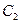 均具有漂白性,二者的漂白原理。(填“相同”或“不同”)
均具有漂白性,二者的漂白原理。(填“相同”或“不同”)
(5)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
3H2+N 2
2  2NH3△H=-92.4kJ·mol-1
2NH3△H=-92.4kJ·mol-1
①当合成氨反应达到平衡后,改变某一外界条件 (不
改变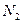 、
、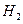 和
和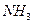 的量),反应速率与时间的关
的量),反应速率与时间的关
系如右图所示。图中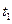 时引起平衡移动的条件可能
时引起平衡移动的条件可能
是,其中表示平衡混合物中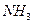 的含量最
的含量最
高的一段时间是。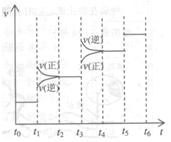
②温度为T℃时,将2a mol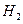 和a mol
和a mol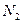 放入0.5 L密闭容器中,充分反应后测得
放入0.5 L密闭容器中,充分反应后测得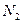 的转化率为50%。则该反应的平衡常数为。
的转化率为50%。则该反应的平衡常数为。
硫酸和硝酸是中学阶段常见的强酸。根据二者与金属的反应情况,回答下列问题:
(1)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是。
A.33.6L B.22.4L C.20.16L D.6.72L
②若向上述反应①的体系中再加入硝酸钠,有什么现象出现?用必要的文字和离子
方程式加以说明。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集气体1.12L(标准状况),则该气体的成分是 ,反应中所消耗的硝酸的物质的量可能为下列数据中的。
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
有一无色溶液,含有N a+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的许多种。取该溶液进行如下实验:
a+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的许多种。取该溶液进行如下实验:
①取适量溶液,加入过量盐酸,有气体生成,并得到溶液。
②在①所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲。
③在②所得溶液中加入过量浓Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是;
(2)一定存在的离子是;
(3)判断沉淀乙成分的方法是。
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应①②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为极易溶于水且易液化.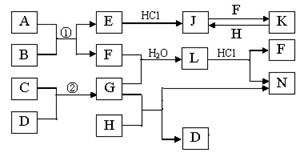
(1)化合物A中含有的短周期元素是(写元素符号),E的化学式_______。
(2)如何检验化合物N中的阳离子。
(3)写出J与F反应的离子方程式:,G与H反应的化学方程式:。
(4)等物质的量F和H的混合气体通入品红溶液中的现象为,原因是(用化学反应方程式表示)。
(5)已知C与D反应生成1.7g G 时放出4.26kJ的热量,则该反应的热化学方程式为
。