Ⅰ某同学帮助水质检测站配制480 mL 0.5 mol/LNaOH溶液以备使用.
(1)该同学应选择 mL的容量瓶.
(2)其操作步骤如乙图所示,则甲图操作应在乙图中的 (填选项字母)之间. 

A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体 g,用质量为23.1 g的烧杯放在托盘天平上称取所需 NaOH固体时,请在附表中选取所需的砝码大小 (填字母),并在下图中选出能正确表示游码位置的选项 (填字母).
NaOH固体时,请在附表中选取所需的砝码大小 (填字母),并在下图中选出能正确表示游码位置的选项 (填字母).
附表 砝码规格
| |
a |
b |
c |
d |
e |
| 砝码大小/g |
100 |
50 |
20 |
10 |
5 |

(Ⅱ)如图是医院病人输液时用的一瓶质量分数为5%的葡萄糖注射液标签,请认真观察标签上的所列内容后填写:
(1)该溶液中含水 g.
(2)该溶液的密度为 g/mL.
(3)该溶液的物质的量浓度为 mol/L
用下列仪器的编号回答问题:①容量瓶②蒸馏烧瓶③分液漏斗④量筒⑤试管⑥烧杯⑦蒸发皿⑧坩埚
(1)可以直接用酒精灯加热的是;
(2)使用时必须检查是否漏水的是。
(每空2分,共14分)某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_____________。乙厂的废水中含有另外三种离子。对于该两厂的废水,可采取下列两种方法来处理。
(1)如果在废水中加一定量(选填:活性炭或铁粉),可以发生反应,离子方程式是,并且能够回收其中的金属(填写金属元素符号)。
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式:;。经过滤后的废水主要含,可用来浇灌农田。
(每空2分,共12分)用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸,步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③稀释,转移④洗涤,再转移⑤定容、摇匀
(1)所需浓硫酸的体积是,量取浓硫酸所用的量筒的规格是(填序号)
(从下列规格中选用 A. 10ml B. 20ml C. 50ml D. 100ml)
(2)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大、偏小、无影响”填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的凹液面
(每空2分,共12分).
(1)下列说法不正确的是。
A.用100mL的容量瓶准确量取100mL液体
B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
C.用托盘天平称量NaCl固体时,NaCl放在称量纸上,称量NaOH固体时,NaOH放在小烧杯里
(2)回答下列问题(填序号):
下列仪器中:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥量筒⑦燃烧匙。
常用于物质分离的是,其中根据物质沸点不同来分离物质的仪器是。
(3)用适当的试剂或方法除去下列物质中所混有的少量杂质,写出有关的反应方程式。
铁粉中混有少量铝粉;
FeCl3中混有少量FeCl2;
固体 Na2CO3中混有少量NaHCO3。
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10 mL 2% H2O2溶液 |
无 |
| ② |
10 mL 5% H2O2溶液 |
无 |
| ③ |
10 mL 5% H2O2溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ |
10 mL 5% H2O2溶液+少量HCl溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ |
10 mL 5% H2O2溶液+少量NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为___________________。
(3)实验①和②的目的是___________________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。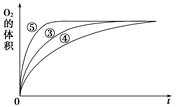
分析上图能够得出的实验结论是_____________________________________________。