某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10 mL 2% H2O2溶液 |
无 |
| ② |
10 mL 5% H2O2溶液 |
无 |
| ③ |
10 mL 5% H2O2溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ |
10 mL 5% H2O2溶液+少量HCl溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ |
10 mL 5% H2O2溶液+少量NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为___________________。
(3)实验①和②的目的是___________________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。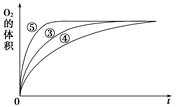
分析上图能够得出的实验结论是_____________________________________________。
具有还原性的无水草酸是无色无臭的透明结晶或白色粉末。草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳。
(1)草酸(H2C2O4)分解的化学方程式为:,
下列装置中,可用于草酸分解制取气体的是。(填字母)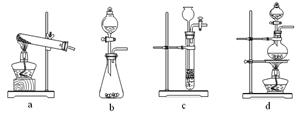
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),实验装置如下图所示,请回答: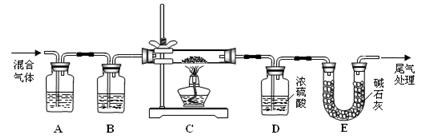
① 为得 到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是、。
到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是、。
② 在点燃酒精灯之前应进行的操作是:(a);(b)通入混合气体一段时间。
③准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =(假定Fe和H2O不发生反应,实验过程中每步均完全吸收或反应)。
④在本实验中,下列情况会使测定结果n偏大的是(填字母)。
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3·nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
①请完成以下实验设计表(表中不要留空格):
(每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂的用量可选择0.5g、0g)
| 实验 编号 |
实验目的 |
T/K |
催化剂用量/g |
C/mol·l-1:] |
|
| KMnO4 |
H2C2O4 |
||||
| ① |
为以下实验作参考 |
298 |
0.5 |
0.01 |
0.1 |
| ② |
探究KMnO4酸性溶液的浓度对该反应速率的影响 |
298 |
0.5 |
0.001 |
0.1 |
| ③ |
323 |
0.5 |
0.01 |
0.1 |
|
| ④ |
探究催化剂对反应速率的影响 |
0.1 |
②若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间。请你设计出
通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案。
(12分)某同学对丙醛的银镜反应进行了研究:
I .配制银氨溶液:
.配制银氨溶液:
(1)配制银氨溶液时,把氨水滴入硝酸银溶液的操作关键是:
(2)配制银氨溶液过程中涉及的离子方程式为
II.探究银镜反应的最佳实验条件(部分实验数据如下表):
| 实验变量 实验序号 |
银氨溶液 的量/mL |
乙醛的量/滴 |
水浴温度/0C |
反应混合液 的pH |
出现银镜 的时间/min |
| 1 |
1 |
3 |
65 |
11 |
5 |
| 2 |
1 |
3 |
45 |
11 |
6.5 |
| 3 |
1 |
5 |
65 |
11 |
4 |
| 4 |
1 |
3 |
30 |
11 |
9 |
| 5 |
1 |
3 |
50 |
11 |
6 |
| 6 |
1 |
5 |
80 |
11 |
3 |
(3)若只进行实验1 和实验3,其探究目的是
和实验3,其探究目的是
(4)当银氨溶液的量为1 mL,乙醛的用量为3滴,水浴温度为 400C,反应混合液pH为11时,出现银镜的时间范围应该是
400C,反应混合液pH为11时,出现银镜的时间范围应该是
(5)若还要探究银氨溶液的用量对出现银镜快慢的影响,如何进行实验?
(4分)下列实验操作不正确的是(填字母代号)。
A.在催化剂存在的条件下,苯和溴水发生反应可 生成无色、比水重的液体溴苯。 生成无色、比水重的液体溴苯。 |
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛 的实验。 的实验。 |
| C.醇中含有少量水可加入生石灰再蒸馏制得无水乙醇。 |
D.试管中先加入一定量浓硫酸,再依次加入冰醋酸、无水乙醇 ,然后加热制取乙酸乙酯。 ,然后加热制取乙酸乙酯。 |
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动。
F.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液。
G.实验室蒸馏石油时温度计水银球插入石油中测量温度,收集600C~1500C馏分得到汽油。
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
⑴白色沉淀A加试剂②反应的离子方程式是__________________________________。
⑵无色溶液C加试剂③的主要目的是____________ ________________________。
________________________。
⑶白色沉淀A若加试剂③而不加试剂②,对实验的影响是_______________________。
⑷气体E通入试剂④发生反应的离子方程式是__________________________________。
某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱。
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易生华;③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示。
| 水 |
四氯化碳 |
|
| 溴 |
黄→棕 |
橙→橙红 |
| 碘 |
深黄→褐 |
紫→深紫 |
实验方案:该小组设计下图所示装置实验(夹持仪器已略去,装置气密性完好)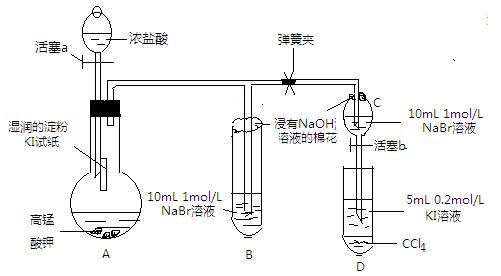
实验过程:
Ⅰ 先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ 当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ 当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ … …
回答以下问题:
⑴验证氯气的氧化性强于碘的实验现象是,写出该反应的化学方程式;
⑵为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是,写出
该反应的离子方程式;
⑶由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为;
⑷你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点