具有还原性的无水草酸是无色无臭的透明结晶或白色粉末。草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳。
(1)草酸(H2C2O4)分解的化学方程式 为: ,
下列装置中,可用于草酸分解制取气体的是 。(填字母)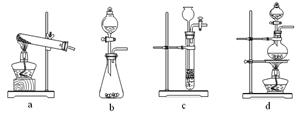
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),实验装置如下图所示,请回答: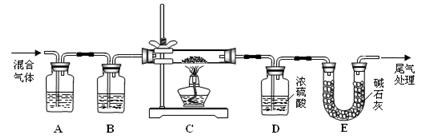
① 为得 到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是 、 。
到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是 、 。
② 在点燃酒精灯之前应进行的操作是:(a) ;(b)通入混合气体一段时间。
③ 准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃 管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n = (假定Fe和H2O 不发生反应,实验过程中每步均完全吸收或反应)。
④ 在本实验中,下列情况会使测定结果n偏大的是 (填字母)。
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3·nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
① 请完成以下实验设计表(表中不要留空格):
(每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂 的用量可选择0.5g、0g)
| 实验 编号 |
实验目的 |
T/K |
催化剂用量/g |
C/mol·l-1:] |
|
| KMnO4 |
H2C2O4 |
||||
| ① |
为以下实验作参考 |
298 |
0.5 |
0.01 |
0.1 |
| ② |
探究KMnO4酸性溶液的浓度对该反应速率的影响 |
298 |
0.5 |
0.001 |
0.1 |
| ③ |
|
323 |
0.5 |
0.01 |
0.1 |
| ④ |
探究催化剂对反应速率的影响 |
|
|
|
0.1 |
② 若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间。请你设计出
通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案 。
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是。
(2)pH≈4的原因是(用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是;证明原因②的实验方案是。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。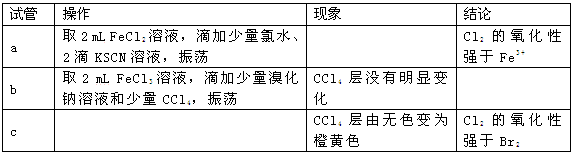
(共14分)用18mol/L的浓硫酸配制3mol/L的稀硫酸100mL,按正确的操作顺序,将序号
填入括号内并填写下列空格。
( )用少许蒸馏水洗涤小烧杯,将洗涤液沿_______注入__________并重复2次。
( )将浓硫酸沿烧杯壁慢慢注入盛有少量蒸馏水的小烧杯中,并用玻璃棒不断搅拌。
( )用量筒取浓硫酸______mL。
( )将容量瓶盖紧摇匀。
( )将已冷却的硫酸溶液沿________ 注入________ 中。
( )改用胶头滴管加蒸馏水,使溶液凹液面最低处恰好与刻度线相切。
( )继续向容量瓶内小心加蒸馏水,直至接近刻度线__________cm处。
若实验遇到下列情况,对所配溶液中硫酸的物质的量浓度有何影响(填偏高、偏低、无影响)。
(1)用量筒量取浓硫酸时俯视刻度线___________;
(2)稀释过程中不慎有硫酸液滴溅出____________;
(3)未将洗涤液加入容量瓶___________;
(4)定容时仰视刻度线__________;
(5)摇匀后发现凹液面下降,又加蒸馏水至刻度线__________;
(6)配制前容量瓶用水洗涤后未进行干燥处理__________。
实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)容量瓶上需标有以下五项中的;
①温度②浓度③容量④压强⑤刻度线
(2)配制时,其正确的操作顺序是(字母表示);
①用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
②用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
④将容量瓶盖紧,颠倒摇匀
⑤改用胶头滴管加水,使溶液凹面恰好与刻度相切
⑥继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
配制时所需的主要实验仪器有
(4)下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
①用纸称量NaOH固体。 ____________;
②向容量瓶加水定容后摇匀,发现液面低于刻度线,不采取任何措施。___;
③有少量NaOH溶液残留在烧杯内。____________;
④向容量瓶加水时眼睛一直俯视液面。____________;
⑤配制前,容量瓶中有少量蒸馏水。____________;
⑥称量NaOH时,砝码错放在左盘。____________。
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H 2C2O4 + 3H2SO4 ="==" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 |
温度/℃ |
试管中所加试剂及其用量/ mL |
溶液褪至无色所需时间/ min |
|||
| 0.6 mol/L H 2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
| 1 |
20 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
| 2 |
20 |
3.0 |
m |
2.5 |
n |
4.8 |
| 3 |
20 |
3.0 |
3.0 |
2.0 |
2.0 |
t1 |
| 4 |
30 |
3.0 |
2.0 |
3.0 |
2.0 |
t2 |
(1)已知:实验1、2、3的目的是探究KMnO4浓度对反应速率的影响。则实验2中m=,
n=。如果研究温度对化学反应速率的影响,需利用实验4和。
(2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如图所示。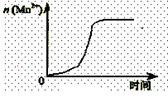
为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用。
①请你填写表中空白帮助该小组同学完成实验方案。
| 实验编号 |
温度/℃ |
试管中所加试剂及其用量/mL |
再向试管中加入少量固体 |
溶液褪至无色所需时间/ min |
|||
| 0.6 mol/L H 2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||||
| 5 |
20 |
3.0 |
2.0 |
3.0 |
2.0 |
t3 |
②能说明该小组同学提出的假设成立的实验事实是。
(3)有人将酸性KMnO4溶液和H 2C2O4溶液的反应设计成原电池,则该原电池的正极反应式为。
实验室里通常用MnO2与浓盐酸反应制取氯气。现用下列有关装置先制取干燥、纯净的氯气。后进行有关性质实验。试根据下列有关装置回答有关问题。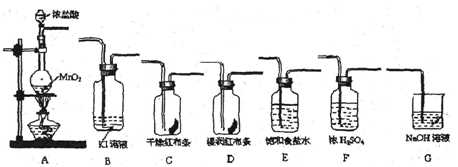
(1)上述装置中各仪器从左至右的连接顺序为A接接接接接接G。
(2)E装置的作用是,D中的现象为,
B中的现象为________________________。
(3)写出相关反应的离子方程式:A中,
G中。
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3- 物质的量之比为1:1的混合液,反应的化学方程式是______________________________________。
(5) 报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________________。