(4分)下列实验操作不正确的是 (填字母代号)。
A.在催化剂存在的条件下,苯和溴水发生反应可 生成无色、比水重的液体溴苯。 生成无色、比水重的液体溴苯。 |
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛 的实验。 的实验。 |
| C.醇中含有少量水可加入生石灰再蒸馏制得无水乙醇。 |
D.试管中先加入一定量浓硫酸,再依次加入冰醋酸、无水乙醇 ,然后加热制取乙酸乙酯。 ,然后加热制取乙酸乙酯。 |
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动。
F.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液。
G.实验室蒸馏石油时温度计水银球插入石油中测量温度,收集600C~1500C馏分得到汽油。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用来消
毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,欲准确测定过氧化
氢的含量。请填写下列空白:
(1)取10.00 mL密度为ρg/mL的过氧化氢溶液稀释至250mL。移取稀释后的过氧化
氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为。
(3)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管
中,滴定到达终点的现象是。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中
过氧化氢的质量分数为。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果(填“偏高”或“偏低”或“不变”)。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用来消
毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,欲准确测定过氧化
氢的含量。请填写下列空白:
(1)取10.00 mL密度为ρg/mL的过氧化氢溶液稀释至250mL。移取稀释后的过氧化
氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为。
(3)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管
中,滴定到达终点的现象是。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中
过氧化氢的质量分数为。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果(填“偏高”或“偏低”或“不变”)。
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:①按图组装仪器,并检查装置的气密性
②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请填空和回答问题:
(1)试剂C的名称为:;
(2)装置中干燥管B的作用是;
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果(填偏高、偏低或不变)
(4)步骤⑤的目的是;
(5)该试样中纯碱的质量分数的计算式为;
(6)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验法。
下图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略)。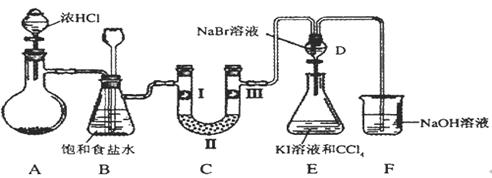
⑴若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式:;
实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2 +2KCl+8H2O
该反应中的氧化剂是,若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是mol;
⑵装置B中饱和食盐水的作用是;
⑶装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______(填编号);(碱石灰为NaOH与CaO混合物,无水氯化钙为中性干燥剂)
| a |
b |
c |
d |
|
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
无水氯化钙 |
碱石灰 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
⑷设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到D中无色溶液逐渐变为________色,若打开D装置的活塞,使D中溶液滴入E装置(KI溶液与CCl4),振荡锥形瓶后静置一会儿,可以观察到的现象是;
⑸装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式。
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有、。
Ⅱ.测定中和热的实验装置如下图所示。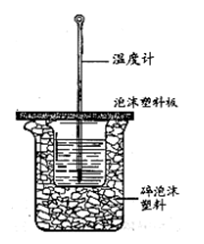
(3)大小烧杯之间填满碎泡沫塑料的作用是,从实验装置上看,图中缺少的一种玻璃仪器。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
| 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
℃ |
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②通过计算可得中和热△H= (精确到小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”、“不相等”),所求中和热(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会(填“偏大”、“偏小”、“不受影响”)。