某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有 、 。
Ⅱ.测定中和热的实验装置如下图所示。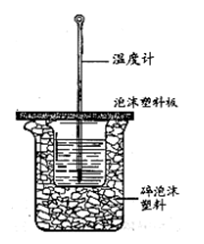
(3)大小烧杯之间填满碎泡沫塑料的作用是 ,从实验装置上看,图中缺少的一种玻璃仪器 。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
| 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
℃ |
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②通过计算可得中和热△H= (精确到小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是 。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。
(11分)某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。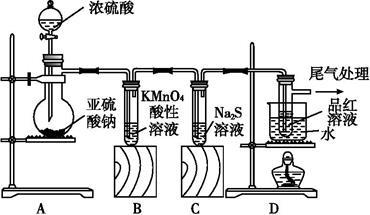
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
( 8分)某兴趣小组用如图装置探究氨的催化氧化。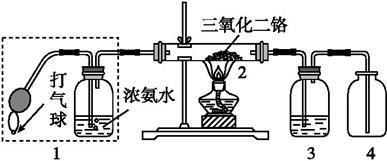
(1)氨催化氧化的化学方程式为 。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是 反应(填“吸热”或“放热”)。
(3)为保证在装置4中观察到红棕色气体,装置3应装入 ;若取消3,在4中仅观察到大量白烟,原因是 。
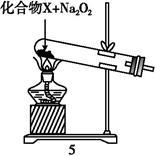
(4)为实现氨的催化氧化,也可用装置5替换装置 (填装置代号);化合物X为 (只写一种),Na2O2的作用是 。
氢氧化铜是一种常用试剂。如:利用新制氢氧化铜验证乙醛的还原性。
(1)新制氢氧化铜悬浊液的配制:在试管里加入10%的氢氧化铜溶液2mL,滴入2%的硫酸铜溶液4~6滴,振荡。这样操作的目的是___________。
(2)下面是某研究性学习小组开展的探究性学习活动:
提出问题:对“乙醛与新制氢氧化铜悬浊液反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,进行了如下探究:
提出猜想:________________________。
查阅资料:①氧化亚铜属于碱性氧化物;
②+1价的铜离子在酸性条件下易发生自身氧化还原反应;
③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀于足量的稀硝酸中,观察溶液颜色变化;
方案2:取该红色沉淀溶于足量的稀硝酸中,观察是否有残渣;
方案3:称取该红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次,直到固体恒重,称得质量为bg,比较a、b的大小;
方案4:取红色沉淀放于大试管里,加入酸化的硝酸银溶液,观察是否有银白色的银析出。
你认为合理的方案是________。
(3)质量分数为11.6%的某饱和一元醛水溶液5g,跟足量新制的Cu(OH)2悬浊液反应,生成Cu2O1.44g。这种醛是________,结构简式为________。它与足量新制Cu(OH)2悬浊液反应的化学方程式为________。
CoCl2•6H2O是一种饲料营养强化剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图: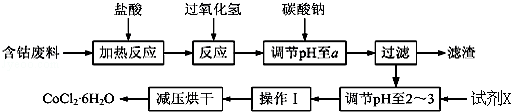
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3
开始沉淀 2.3 7.5 7.6 3.4
完全沉淀 4.1 9.7 9.2 5.2
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 (写一点).
(2)加入碳酸钠调节pH至a,a的范围是 ;pH调至 ,a后过滤,再用试剂X将滤液的pH调节至2﹣3,则所用的试剂X为 .
(3)操作Ⅰ包含3个基本实验操作,它们是 、 和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是 .
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是 .
(6)在实验室中,为了从上述产品中获得纯净的CoCl2•6H2O,常将制得的产品溶解于乙醚中,然后 、 (填实验操作)获得纯净的CoCl2•6H2O
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某实验模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图: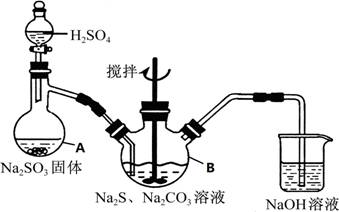
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3•5H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称 ,步骤④中洗涤时,为了减少产物的损失的试剂可以是
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因
(3)最后得到的产品可能含有反应Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论
(4)测定产品纯度
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000mol•L﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为 mL,产品的纯度为 %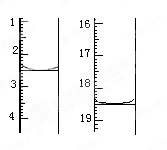
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
(5)Na2S2O3常用于脱氧剂,在溶液易被Cl2氧化SO42﹣,该反应的离子方程式为 .