( 14 分)某无色透明溶液可能含有下列离子:K+、Fe3+、Cu2+、Ba2+、AlO、NO3━、CO32-、SO32-、SO42-、Br-、I-、Cl-。取该溶液按如下步骤进行实验。
(1)请你根据下表Ⅰ栏中的实验结果,回答Ⅱ栏中有关问题:
| Ⅰ实验结果 |
Ⅱ回答问题 |
| ①取原溶液少许,滴加足量氯水,产生沉淀;过滤,滤液加CCl4,振荡后,CCl4层未变色。 |
①该步实验说明溶液中不存在 离子_________________。 |
| ②取原溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色。 |
②该步实验发生反应的离子方程式为 _________________。 |
| ③取原溶液少许,加盐酸酸化后,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失。 |
③产生白色沉淀的离子方程式为 _________________。 |
| ④取原溶液少许,滴加2滴酸性高锰酸钾溶液,紫色立即褪去。 |
④该步实验说明溶液中存在 离子 _________________。 |
| ⑤取原溶液少许,加足量Ba(NO3)2溶液产生白色沉淀,过滤;往洗涤后的沉淀中加入足量盐酸,沉淀部分溶解,有无色气体产生。 |
⑤未溶解的白色沉淀是 ;将气体通入品红溶液的现象是 。 |
| ⑥取步骤⑤所得滤液,加HNO3酸化后,再加AgNO3溶液,溶液中析出白色沉淀。 |
⑥该步骤是否有意义 (填“有”或“无”)。 |
(2)综上,该溶液的pH (填“>”、“<”或“=”)7;该溶液中一定存在的阳离子是 ,不能确定是否存在的离子是 ;现欲取原溶液检验其是否存在,是否要使用试剂,若不要使用试剂,其实验方法是 ;若要使用试剂,选用的试剂是(按使用的先后顺序依次写出)
。
某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验: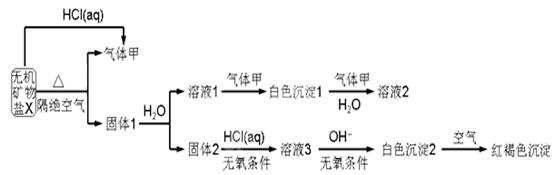
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
二氧化铈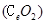 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含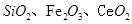 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: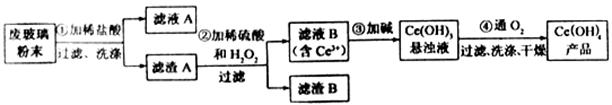
(1)洗涤滤渣A的目的是为了去除(填离子符号),检验该离子是否洗净的方法是。
(2)第②步反应的离子方程式是,滤渣B的主要成分是。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP(填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
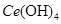 产品0.536g,加硫酸溶解后,用0.1000mol•
产品0.536g,加硫酸溶解后,用0.1000mol•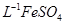 标准溶液滴定至终点时(铈被还原为
标准溶液滴定至终点时(铈被还原为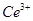 ),消耗25.00mL标准溶液,该产品中
),消耗25.00mL标准溶液,该产品中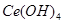 的质量分数为。
的质量分数为。
“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L-1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)=________mol·L-1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O===Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。
| A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 |
| C.利用购买的商品NaClO来配制可能导致结果偏低 |
| D.需要称量的NaClO固体质量为143 g |
某酸性工业废水中含有K2Cr2O7。光照下,草酸能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始pH |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
| ① |
4 |
60 |
10 |
30 |
| ② |
5 |
60 |
10 |
30 |
| ③ |
5 |
60 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为(填化学式)。
(3)实验①和②的结果表明;
实验①中0~t1时间段反应速率 (Cr3+)=mol/(L·min) (用代数式表示)。
(Cr3+)=mol/(L·min) (用代数式表示)。
(4)该课题组队铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:;
假设三:;
…………
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·2H2O、Al2(SO4)3等。溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
(15分)海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘: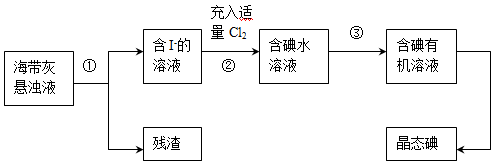
(1)灼烧海带时需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A 烧杯 B 蒸发皿 C.坩埚 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出上图中提取碘的过程中有关的实验操作名称:①,③。
(3)操作③中所用的有机试剂可以是(只填一种),简述选择其理由。
(4)操作过程③可以分解为如下几步:
把盛有溶液的分液漏斗放在铁架台的铁圈中;
把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
检验分液漏斗活塞和上口的玻璃塞是否漏液;
倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
旋开活塞,用烧杯接收溶液;
从分液漏斗上口倒出上层液体;
将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
静置、分层。
(a)过程③正确操作步骤的顺序是:(填编号字母);
(b)上述G步操作的目的是:;
(c)最后碘的有机溶液是通过获得(填“漏斗上口”或“漏斗下口”)。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:。
(6)从含碘的有机溶液中提取碘和回收有机试剂,还需要经过蒸馏,观察下图所示实验装置指出其错误之处。
进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。