人工合成的一种甜味剂的结构简式如右图所示下列说法正确的是 ( )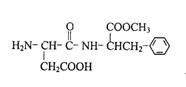
| A.分子式是C14H19N2O5 |
| B.该物质分子中含有2个手性碳原子 |
C.该 物质能发生取 物质能发生取 代、 代、 加成、缩聚反应 加成、缩聚反应 |
| D.1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
T ℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的 浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L·min) |
| C.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
| D.保持其他条件不变,升高温度,化学平衡向逆反应方向移动 |
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是()
| A.a为电池的正极 |
| B.电池充电反应为LiMn2O4=Li1-xMn2Ox+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |
化学与科学、技术、社会和环境密切相关。下列说法正确的是( )
| A.化学平衡常数是指一定条件下的可逆反应,生成物浓度的幂之积与反应物浓度的幂之积的比值。 |
| B.已知4HCl(g)+O2(g)=2H2O(g)+2Cl2(g) 能自发进行,则该反应ΔH<0,ΔS>0 |
| C.其他条件不变,增大压强,平衡可能移动,但平衡常数一定不变 |
| D.铁制品表面镶锌块和铁制品表面镀锡,都能起到防腐的作用且防腐原理是相同的 |
一容器中X元素构成的气态单质X2分子有3种,相对分子质量分别为32、34、36。又知容器中3种分子数之比为15∶4∶1。由此可以确定的是()
| A.若容器中X2全部转化为它的同素异形体X3,那么X3的分子量有3种 |
| B.质量数为16的一种核素在此容器中的原子百分数为85% |
| C.只要容器中同位素组成不变,X原子在任何条件下发生重新组合,最后得到三种 X2,分子数之比总是15∶4∶1 |
| D.此容器中X2的平均分子量是34 |
下列叙述正确的是
| A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 |
| B.在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 |
| C.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1: 2 |
| D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |