2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
| A.a为电池的正极 |
| B.电池充电反应为LiMn2O4=Li1-xMn2Ox+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |
中国疾控中心提供的“放射性核素 I健康相关知识答问”中指出,
I健康相关知识答问”中指出, I是人工放射性核素,正常情况下自然界中不会存在,日本核泄漏事故释放的放射性核素中含有这种核素。下列有关
I是人工放射性核素,正常情况下自然界中不会存在,日本核泄漏事故释放的放射性核素中含有这种核素。下列有关 I的叙述正确的是
I的叙述正确的是
| A.是碘的一种同素异形体 | B.是一种新发现的元素 |
| C.核内的中子数与核外电子数之差为25 | D.位于元素周期表中第4周期ⅦA族 |
如图是进行气体性质实验的常用装置,下列对有关实验现象的说法中不正确的是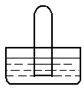
| A.若水槽中是水,试管中是Br2蒸气,可看到试管中液面并未有明显上升 |
| B.若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管 |
| C.若水槽中是水(并滴有一定量酚酞),试管中是NH3,可看到液面上升并呈红色 |
| D.若水槽中是水,试管中是NO,可看到试管中液面并未有明显上升 |
下列说法不正确的是
| A.含有共价键的化合物一定是共价化合物 |
| B.含有离子键的化合物一定是离子化合物 |
| C.在离子化合物中可能存在共价键 |
| D.在共价化合物中不可能存在离子键 |
现有部分短周期元素的性质或原子结构如表:下列叙述正确的是
| 元素代号 |
元素性质或原子结构 |
| T |
M层上的电子数为6个 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈酸性 |
| Z |
元素最高正价是+7 |
A. 元素X的一种同位素可测定文物年代,这种同位素的符号是12C
B.元素Z的非金属性比元素T弱
C.Y和T位于同一主族
D.T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其它三种的是碳酸
X元素最高氧化 物对应的水化物为H3XO4,
物对应的水化物为H3XO4, 则它对应的气态氢化物为
则它对应的气态氢化物为
| A.HX | B.H2X | C.XH3 | D.XH4 |