纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
根据以上信息,同答下列问题:
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)操作A的步骤为 ;
(3)检验“水洗”已经洗净的方法是 ;
(4)测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI品体,再滴入适量2 mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ;
②产品中CaO2的质量分数为 (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) 。
元素铬(Cr)在溶液中主要以 (蓝紫色)、 (绿色)、 (橙红色)、 (黄色)等形式存在, 为难溶于水的灰蓝色固体, 回答下列问题:
(1) 与 的化学性质相似,在 溶液中逐滴加入 溶液直至过量, 可观察到的现象是 。
(2) 和 在溶液中可相互转化。室温下,初始浓度为 的 溶液中 随 的变化如图所示。

①用离子方程式表示 溶液中的转化反应____________。
②由图可知,溶液酸性增大, 的平衡转化率__________(填"增大"减小"或"不变")。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中 的平衡转化率减小,则该反应的 _________(填"大于""小于"或"等于")。
(3)在化学分析中采用 为指示剂,以 标准溶液滴定溶液中的Cl −,利用Ag +与 生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好完全沉淀(浓度等于 )时,溶液中 为_______ ,此时溶液中 等于__________ 。(已知 、 的 分别为 和 )。
(4)+6价铬的化合物毒性较大,常用 将废液中的 还原成 ,反应的离子方程式为______________。
氮的氧化物( )是大气污染物之一,工业上在一定温度和催化剂条件下用 将 还原生 成 , 某同学在实验室中对 与 反应进行了探究。回答下列问题:
(1)氨气的制备
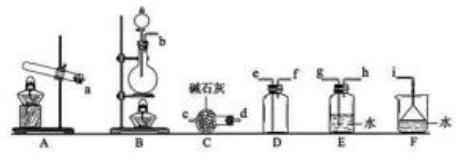
①氨气的发生装置可以选择上图中的_ , 反应的化学方程式为_ 。
②预收集一瓶干燥的氨气,选择上图中的装置, 其连接顺序为: 发生装置→ (按气流方向, 用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的 充入注射器 中, 硬质玻璃管 中加入少量催化剂, 充入 (两端用夹 子 夹好)。在一定温度下按图示装置进行实验。
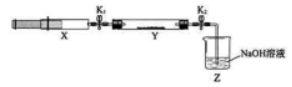
|
操作步骤 |
实验现象 |
解释原因 |
|
打开 , 推动注射器活塞, 使 X中的气体缓慢通入 Y 管中 |
(1)Y 管中 |
(2反应的化学方程式 |
|
将注射器活塞退回原处并固 定, 待装置恢复到室温 |
Y 管中有少量水珠 |
生成的气态水凝集 |
|
打开 |
氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景。通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):

Ⅰ.将浓 、 、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入 粉末。塞好瓶口。
Ⅱ.转至油浴中, 搅拌1小时。缓慢滴加一定量的蒸馏水。升温至 并保持1小时。
Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加 至悬浊液由紫色变为土黄色。
Ⅳ.离心分离,稀盐酸洗涤沉淀。
Ⅴ.蒸馏水洗涤沉淀。
Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(1)装置图中,仪器a、c的名称分别是 、 ,仪器b的进水口是 (填字母)。
(2)步骤Ⅰ中,需分批缓慢加入 粉末并使用冰水浴,原因是 。
(3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是 。
(4)步骤Ⅲ中, 的作用是 (以离子方程式表示)。
(5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在 来判断。检测的方法是 。
(6)步骤Ⅴ可用 试纸检测来判断 是否洗净,其理由是 。
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO 4•7H 2O ):

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
|
金属离子 |
Ni 2+ |
Al 3+ |
Fe 3+ |
Fe 2+ |
|
开始沉淀时(c=0.01 mol•L ﹣ 1)的pH 沉淀完全时(c=1.0×10 ﹣ 5mol•L ﹣ 1)的pH |
7.2 8.7 |
3.7 4.7 |
2.2 3.2 |
7.5 9.0 |
回答下列问题:
(1)"碱浸"中NaOH的两个作用分别是 。为回收金属,用稀硫酸将"滤液①"调为中性,生成沉淀。写出该反应的离子方程式 。
(2)"滤液②"中含有的金属离子是 。
(3)"转化"中可替代H 2O 2的物质是 。若工艺流程改为先"调pH"后"转化",即  ,"滤液③"中可能含有的杂质离子为 。
,"滤液③"中可能含有的杂质离子为 。
(4)利用上述表格数据,计算Ni(OH) 2的K sp= (列出计算式)。如果"转化"后的溶液中Ni 2+浓度为1.0mol•L ﹣ 1,则"调pH"应控制的pH范围是 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH.写出该反应的离子方程式 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是 。
氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备
KClO 3和NaClO,探究其氧化还原性质。

回答下列问题:
(1)盛放MnO 2粉末的仪器名称是 ,a中的试剂为 。
(2)b中采用的加热方式是 。c中化学反应的离子方程式是 ,采用冰水浴冷却的目的是 。
(3)d的作用是 ,可选用试剂 (填标号)。
A.Na 2S B.NaCl C.Ca(OH) 2D.H 2SO 4
(4)反应结束后,取出b中试管,经冷却结晶, , ,干燥,得到KClO 3晶体。
(5)取少量KClO 3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl 4振荡,静置后CCl 4层显 色。可知该条件下KClO 3的氧化能力 NaClO(填"大于"或"小于")。