某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO 4•7H 2O ):

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 |
Ni 2+ |
Al 3+ |
Fe 3+ |
Fe 2+ |
开始沉淀时(c=0.01 mol•L ﹣ 1)的pH 沉淀完全时(c=1.0×10 ﹣ 5mol•L ﹣ 1)的pH |
7.2 8.7 |
3.7 4.7 |
2.2 3.2 |
7.5 9.0 |
回答下列问题:
(1)"碱浸"中NaOH的两个作用分别是 。为回收金属,用稀硫酸将"滤液①"调为中性,生成沉淀。写出该反应的离子方程式 。
(2)"滤液②"中含有的金属离子是 。
(3)"转化"中可替代H 2O 2的物质是 。若工艺流程改为先"调pH"后"转化",即  ,"滤液③"中可能含有的杂质离子为 。
,"滤液③"中可能含有的杂质离子为 。
(4)利用上述表格数据,计算Ni(OH) 2的K sp= (列出计算式)。如果"转化"后的溶液中Ni 2+浓度为1.0mol•L ﹣ 1,则"调pH"应控制的pH范围是 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH.写出该反应的离子方程式 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是 。
辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示: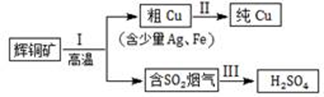
(1) Cu2S中Cu元素的化合价是 价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的 极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是 。
③电解一段时间后,溶液中Cu2+浓度 (填“减小”、“增大”、“不变”)。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。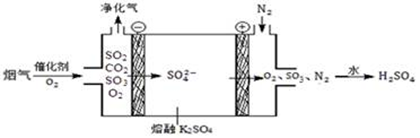
① 在阴极放电的物质是___________。
② 在阳极生成SO3的电极反应式是____________。
(4)检测烟气中SO2脱除率的步骤如下:
i.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
ii.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
iii.过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示i中溴水的主要作用____________。
②若沉淀的质量越大,说明SO2的脱除率越____________(填“高”或“低”)。
(5)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。H3PO2是一元中强酸,写出其电离方程式 ·
③NaH2PO2为_ (填“正盐”或“酸式盐”)其溶液显 (填“弱酸性”、“中性”或“弱碱性”)。
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
实验步骤:
在A中加入4.4g异戊醇,6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别依次用少量水、饱和碳酸氢钠溶液且再用水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊脂3. 9 g。
回答下列问题:
(1)仪器B的名称是 ;
(2)在洗涤操作中,第一次水洗的主要目的是 ,第二次水洗的主要目的是 ;
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号〕 .
a、直接将乙酸异戊酯从分液漏斗的上口倒出
b、直接将乙酸异戊酯从分液端斗的下口放出
c、先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d、先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是 .
(5)实验中加入少量无水MgSO4的目的是 ·
(6)在蒸馏操作中,仪器选择及安装都正确的是_ (填标号)。
(7)本实验的产率是_ (填标号).
a.30 %b.40 %c.60% d.90%
(8)在进行蒸馏操作时:若从130℃便开始收集馏分,会使实验的产率偏_ (填“高”或“低”),其原因是 。
实验室里要配制465 mL 0.2 mol/L的硫酸钠溶液。
(1)请填写下列空白:
| A.计算、称量、溶解:在天平上称出________g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。 |
| B.转移:把得到的溶液冷却后小心地沿着________注入________中。 |
| C.洗涤:用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。 |
| D.定容:继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm,改用________小心滴加蒸馏水至溶液凹液面底部与刻度线相切。 |
E.摇匀:将瓶塞塞紧,充分摇匀。
F.贴标签、装试剂瓶:将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(2)下列情况会使所配溶液浓度偏高的是________(填字母)。
a.某同学定容时俯时容量瓶刻度线
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线又加水了
d.进行B操作时将少量液体洒到外面
e.未冷却至室温就进行转移
为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下所示方案进行实验。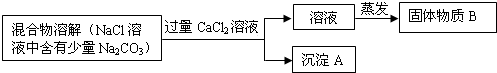
(1)沉淀A的化学式是________。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作过程是___________。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。固体物质B的成分为________(用化学式表示)。
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后加热煮沸。有关反应的化学方程式为______________。
(13分)半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)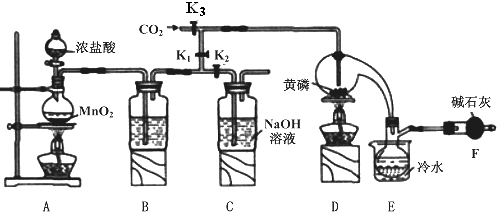
已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。
②PCl3遇水会强烈水解生成H3PO3和HCl;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3。
④PCl3、POCl3的熔沸点如表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为____________。
(2)B中所装试剂是_______;F中碱石灰的作用有两种,分别是______、_______。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是_______。
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为_______。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL。
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应,该产品中PCl3的质量分数为_________。