乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

实验步骤:
在A中加入4.4g异戊醇,6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别依次用少量水、饱和碳酸氢钠溶液且再用水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊脂3. 9 g。
回答下列问题:
(1)仪器B的名称是 ;
(2)在洗涤操作中,第一次水洗的主要目的是 ,第二次水洗的主要目的是 ;
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号〕 .
a、直接将乙酸异戊酯从分液漏斗的上口倒出
b、直接将乙酸异戊酯从分液端斗的下口放出
c、先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d、先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是 .
(5)实验中加入少量无水MgSO4的目的是 ·
(6)在蒸馏操作中,仪器选择及安装都正确的是_ (填标号)。

(7)本实验的产率是_ (填标号).
a.30 % b.40 % c.60% d.90%
(8)在进行蒸馏操作时:若从130℃便开始收集馏分,会使实验的产率偏_ (填“高”或“低”),其原因是 。
某混合碱是①Na2CO3和NaHCO3或② Na2CO3和 NaOH。用“ 双指示剂法”对样品的组分和总碱量 [n(Na2O)]进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馏水和几滴酚酞,用0.0100 mol•L-1的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿——二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
(1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第I次滴定的第一个终点的液面如图所示,请读出实验数据,填入下列表格中
| 序号 |
第一滴定终点的读数(V1/mL) |
第二滴定终点的读数(V2/mL) |
| I |
26.85 |
|
| II |
10.02 |
25.02 |
| III |
9.98 |
24.98 |
(2)该混合碱样品的组成为。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计。
实验室合成丙酸乙酯的反应装置如下图甲,其操作过程为:在图甲装置的二口烧瓶中加入浓硫酸和乙醇的混合物,再通过恒压滴液漏斗逐步加入一定量的丙酸,同时加热回流。
(1)请写出图甲中酯化反应的化学方程式。
(2)已知酯化反应的催化剂为 ,图甲中选用浓硫酸而不选用稀硫酸的目的是。
,图甲中选用浓硫酸而不选用稀硫酸的目的是。
(3)图甲中除了制得产物酯外,因反应温度控制不当,还可能发生副反应产生的有机产物有。
(4)为了得到纯净的酯,将图甲中反应后的混合液改装成图乙装置进行蒸馏分离时,图乙方框中应选用图丙中的冷凝管(选填“A”或“B”)。
(5)用图甲装置制取酯比用图丁装置制取酯的优点在于。
下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见下表: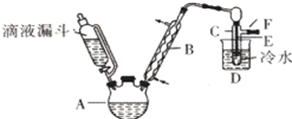
乙醇、溴乙烷、溴有关参数:
| 乙醇 |
溴乙烷 |
溴 |
|
| 状态 |
无色液体 |
无色液体 |
深红棕色液体 |
| 密度/g•cm-3 |
0.79 |
1.44 |
3.1 |
| 沸点/℃ |
78.5 |
38.4 |
59 |
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是(选填序号)。
a.减少副产物烯和醚的生成b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂
(2)已知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式。
(3)仪器B的名称,冷却水应从B的(填“上”或“下”)口流进。
(4)反应生成的溴乙烷应在中(填“A”或“C”中)。
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列(选填序号)溶液来洗涤产品。
a.氢氧化钠b.亚硫酸钠c.碘化亚铁 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有。
某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应 来制取并收集氯气,实验装置如下图所示。
来制取并收集氯气,实验装置如下图所示。

 (1)写出该反应的离子方程式:。
(1)写出该反应的离子方程式:。 (2)上述反应中,盐酸表现出性质是。
(2)上述反应中,盐酸表现出性质是。
 (3)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是。
(3)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是。
| A.NaOH 溶液 | B.Na2CO3溶液 | C.饱和食盐水 | D.浓硫酸 |
 (4)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,可以收集到标准状况下的氯气体积(填大于、小于或等于)2.24L,原因是
(4)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,可以收集到标准状况下的氯气体积(填大于、小于或等于)2.24L,原因是
设计一个简单的一次性完成的实验装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH。
(1)利用如图所示的仪器可以组装实验装置,则仪器的连接顺序为________接________,________接________,________接________。
(2)试管中的现象是______________________________________________。
(3)有关化学方程式是______________________________________________。