三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅数据知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
(一)提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______________。简述你的理由________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。写出实验过程中发生反应的离子方程式________________、_______________、__________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为_______。
Ⅰ.将氯水滴到蓝色石蕊试纸上,现象是____________;将H2SO4(aq)滴到蓝色石蕊试纸上,现象是____________;将浓H2SO4滴到湿润的蓝色石蕊试纸上,现象是____________。
Ⅱ.设计实验:只用BaCl2溶液作试剂鉴别Na2SO3溶液和H2SO4稀溶液。要求:只写出实验方法、现象和结论。
A、B两课外活动小组欲从废CuO中回收Cu,实验室提供了Zn和稀H2SO4两种原料,两小组分别设计了自己的实验方案:
你认为A组方案_____________(填“优于”或“劣于”)B组方案,原因是__________________________。
设计一个只用BaCl2溶液及试管鉴别Na2SO3溶液和稀硫酸的实验,简要写出鉴别过程。
将过量的铁粉投入一定量的热浓硫酸中(含2 mol H2SO4),按照中学教材上H2SO4与铁反应的有关知识填空:
(1)若反应结束后,有1.5 mol铁被溶解,产生的气体是_______,质量为_______g。
(2)反应停止后,有W g铁粉溶解,产生的SO2在标准状况下所占有的体积是_______L。
实验室可用碳酸钠制备少量亚硫酸钠晶体,有关装置如下图所示: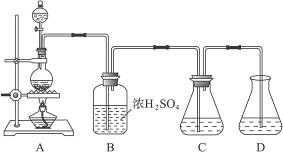
将17 g Na2CO3溶于80 mL水中,分装在C、D两个锥形瓶中,再将25 g铜屑放入圆底烧瓶中,将60 mL浓H2SO4和10 mL水的混合液装在分液漏斗中,逐滴加入硫酸后,小心加热使SO2逐渐产生(注意控制气量大小和反应速率的快慢)。将SO2通入Na2CO3溶液中至饱和,在合并C、D两瓶所得溶液中,慢慢加入17 g Na2CO3,蒸发浓缩,冷却后得亚硫酸钠晶体。试回答:
(1)如何配制60 mL浓H2SO4与10 mL水的混合液?
(2)装置B中浓H2SO4的作用:______________________________________________________;
(3)Na2SO3溶液要分装在两个锥形瓶中的理由是__________________;写出C中发生反应的离子方程式__________________;
(4)控制SO2产生速度的方法是_____________________________________________;
(5)通SO2结束后,加Na2CO3的目的是____________________________________。