利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+O2(g)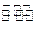 2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正) v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正) v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。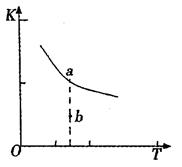
(2)若反应物起始的物质的量相同,下列关系图不正确的是 (填序号)。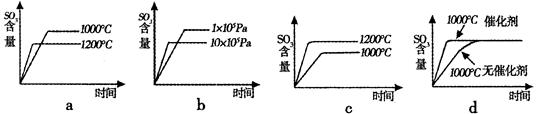
(3)某硫酸厂利用SO2尾气、废铁屑、空气、水合成绿矾(FeS04·7H2O),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到(NH4)2SO3和(NH4)2SO4两种化工原料。
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO2-3)十c(HSO-3)+c(H2SO3)]=c(NH+4)+c(NH3·H2O)
请分析该同学的依据是 。
②在(NH4)2 SO4溶液中存在:NH+4+ H2O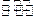 NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数K=1.
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数K=1. 7×10-
7×10- 5)
5)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强 (pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO4,应尽快用大量0. 5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为mol/L(已知25℃时,Ksp(BaSO4)=1×l0-10 ,Ksp
(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO4,应尽快用大量0. 5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为mol/L(已知25℃时,Ksp(BaSO4)=1×l0-10 ,Ksp (BaCO3)=1×10-9).
(BaCO3)=1×10-9).
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用所给的工艺流程生产单质碘:
(1)碘位于元素周期表中的第_______周期第 族。
(2)步骤③加Fe的目的是__________________
(3)写出步骤④的化学方程式:________________。
(4)上述生产流程中,可以循环利用的副产物是 ,己知上述流程得到的该副产物含杂质,现需将其制成生产所需的试剂,先后还需加入__________、__________来进行处理。
(5)甲物质见光易变黑,其原因是(用化学方程式表示)__________。
(6)第⑤步操作可供提纯I2的两种方法是 和__________。
有X、Z、W三种含14个电子的粒子,其结构特点如下:
| 粒子代码 |
X |
Z |
W |
| 原子核数目 |
单核 |
同元素构成的两核 |
同元素构成的两核 |
| 粒子的电性 |
电中性 |
两个负电荷 |
电中性 |
(1)X的氧化物晶体中含有化学键类型是_____________。
(2)Z与钙离子组成的化合物的电子式为_____________。
(3)组成W的元素的简单氢化物极易溶于水的主要原因是 ,该氢化物与空气可以构成一种燃料电池,产物为无毒物质,电解质溶液是KOH溶液,其负极的电极反应式为____ 。在常温下,用该电池电解1.5 L 1mol/LNaCl溶液,当消耗标准状况下1.12LW的简单氯化物时,NaCl溶液的pH=
(假设电解过程中溶液的体积不变)。
(4)M原子核外比X原子多2个电子。可逆反应2MO2(气)+O2(气) 2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
(5)欲比较X和M两元素的非金属性相对强弱,可采取的措施有 (填序号)。
a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易
分别在密闭容器的两个反应室中进行如下反应:
左反应室:A(g)+2B(g) 2C(g) 右反应室:2Z(g)
2C(g) 右反应室:2Z(g) X(g)+Y(g)
X(g)+Y(g)
在反应室之间有无摩擦、可自由滑动的密封板隔断。反应开始和达到平衡时有关物理量的变化如下图所示:
(1)A(g)+2B(g) 2C(g) 的△H 0(填“>”、“<”或“=”)。
2C(g) 的△H 0(填“>”、“<”或“=”)。
(2)在平衡(I)和平衡(Ⅱ)中,X的体积分数 (填序号)。
a.一定相等 b.一定不相等 c.可能相等
(3)达到平衡(I)时,A的转化率为 。
“2015.8.12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。已知部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 ( 25℃) |
Ki=1.77×10-4 |
Ki=5.0×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)根据价键规则,写出HCN的结构式是 ;
(2)下列能用于判断氮、碳两种元素非金属性强弱的是________。(填序号)
a.气态氢化物沸点
b.最高价氧化物对应水化物酸性强弱
c.Al2O3 + N2 + 3C ="=" 2AlN + 3CO
d.单质晶体类型
(3)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是 ;通过列式计算“c(CN-)与c(HCN)”的大小 判断:c(CN-) c(HCN)(填“>”、“<”或“=”)
(4)含CN﹣的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN﹣氧化成CNO﹣。CNO﹣在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN﹣被处理的百分率。
将浓缩后含CN﹣的废水与过量NaClO溶液的混合液(其中CN﹣浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为 ;乙中反应的离子方程式为 。
②乙中生成的气体除CO2、N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN﹣的处理效果.丙中加入的除杂试剂是 (填标号)。
(A)饱和食盐(B)饱和NaHCO3溶液(C)浓NaOH溶液(D)浓硫酸
丁在实验中的作用是 。戊中盛有足量的石灰水,若实验后戊中共生成0.8g沉淀,则该实验中CN﹣被处理的百分率 80%(填“>”、“二”或“<”=)。
(I)向一体积不变的密闭容器中充入2 mol A,0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g) 3C(g),各物质的浓度随时间变化的关系如图 1所示,其中t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况且t2,t3,t4各改变一种不同的条件。
3C(g),各物质的浓度随时间变化的关系如图 1所示,其中t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况且t2,t3,t4各改变一种不同的条件。
(1)若t1=15 min,则t0~t1阶段以C的浓度变化表示的反应速率v(C)=__________。
(2)t3时改变的条件为__________________,B的起始物质的量为__________________,
(3)t4~t5阶段,若A的物质的量减少了0.01 mol,而此阶段中反应体系吸收能量为a kJ,
写出此条件下该反应的热化学方程式:__________________。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa |
2×105 |
5×105 |
1×106 |
| c(A)/mol·L-1 |
0.08 |
0.20 |
0.44 |
⑴当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
⑵维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol。
⑶当压强为1×106 Pa时,此反应的平衡常数表达式: 。