有Fe2+﹑NO3-﹑Fe3+、NH4+﹑H2O和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是
| A.氧化剂与还原剂的物质的量之比为8∶1 |
| B.还原产物为NH4+ |
| C.若有1molNO3- 参加还原反应,则转移3mol e- |
| D.若把该反应设计为原电池,则负极反应为 Fe2+ - e _ = Fe3+ |
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是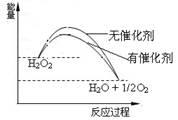
| A.加入催化剂,减小了反应的热效应 |
| B.加入催化剂,可提高H2O2的平衡转化率 |
| C.H2O2分解的热化学方程式: H2O2 = H2O + 1/2O2△H<0 |
| D.反应物的总能量高于生成物的总能量 |
下列说法中,错误的是
| A.反应的平衡转化率能表示在一定温度和一定起始浓度下反应进行的限度 |
| B.金属在发生电化学腐蚀的过程中,总是作为原电池负极的金属被氧化而腐蚀 |
| C.如果某化学反应的△H和△S均小于0,则反应一定能自发进行 |
| D.SO2催化氧化时,加入过量O2时可提高SO2的转化率 |
已知A(g)+3B(g)=2C(g)+2D(g),若反应速率分别用ν(A)、ν(B)、ν(C)、ν(D)表示,下列反应速率中最快的是
A.ν(A)= 0.15mol·L-1·s-1
B.ν(B)= 0.60mol·L-1·s-1
C.ν(C)=" 0.40" mol·L-1·s-1
D.ν(D)= 0.45mol·L-1·s-1
下列有关金属防护的说法不正确的是
| A.通过镶嵌锌块保护船体的方法叫牺牲阳极的阴极保护法 |
| B.埋铁制管线时应选择致密、干燥的土壤层 |
| C.青铜器表面覆盖防渗高分子膜,可防止铜绿形成 |
| D.纯银器表面在空气中因电化学腐蚀渐渐变暗 |
用图所示装置除去含CN—、Cl—废水中的CN—时,控制溶液pH为9~10,阳极产生的ClO—将CN—氧化为两种无污染的气体,下列说法不正确的是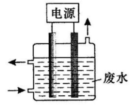
| A.用石墨作阳极,铁作阴极 |
| B.阳极的反应式为:Cl-+2OH- -2e-=ClO-+H2O |
| C.阴极的反应式为:2H2O+2e-=H2↑+2OH- |
| D.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |