现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。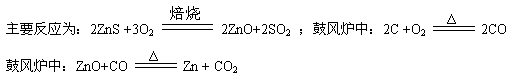
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为: 、 。
(2)湿法炼锌的主要工艺流程为
①硫酸浸取的主要反应的离子方程式为: 。
②从保护环境和充分利用原料角度,如何处理或利用烟气 。
③除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
④酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知CdO为碱性氧化物,Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式 ___________ 、 。
SCR是一种烟气脱硝技术(除去烟气中的NOx),其流程如下: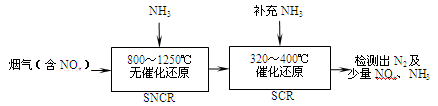
(1)反应2NO+2CO 2CO2+N2的平衡常数表达式为 。
2CO2+N2的平衡常数表达式为 。
(2)SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)ΔH=-1627.2kJ•mol-1;
4N2(g)+6H2O(g)ΔH=-1627.2kJ•mol-1;
6NO(g)+4NH3(g) 5N2(g)+6H2O(g)ΔH=-1807.0 kJ•mol-1;
5N2(g)+6H2O(g)ΔH=-1807.0 kJ•mol-1;
6NO2(g)+8NH3(g) 7N2(g)+12H2O(g)ΔH=-2659.9 kJ•mol-1;
7N2(g)+12H2O(g)ΔH=-2659.9 kJ•mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH= kJ•mol-1。
2NO(g)的ΔH= kJ•mol-1。
(3)NO和NH3在Ag2O催化剂表面的反应活性随温度的变化曲线见下图。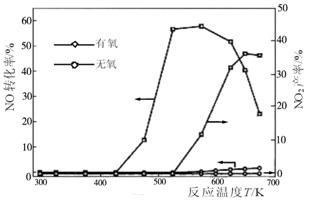
①由图可以看出,脱硝工艺流程应在 (填“有氧”或“无氧”)条件下进行。
②随着反应温度的进一步升高,在有氧的条件下NO的转化率明显下降的可能原因是 。
(4)NO也可用尿素[CO(NH2)2]还原,写出尿素与NO反应的化学方程式: 。
(5)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图: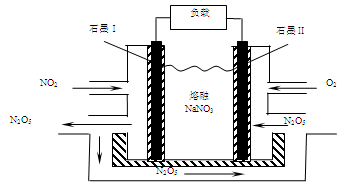
写出石墨Ⅱ发生的电极反应为 。若生成1molN2O5,则理论上需要消耗标准状况下O2的体积为 L。
铜工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
(1)金属M为 ,操作1中需要的主要玻璃仪器是玻璃棒、______、______。
(2)加入新制氯水的的作用是(用离子方程式表示) __________ 。滤渣D的主要成分是 (填化学式)。
(3)充分焙烧的化学方程式为 。如下图所示,焙烧操作中的一处错误是_________。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。则操作2中得到固体C的实验操作是:蒸发浓缩、 ,洗涤、干燥。90℃时Ksp(Li2CO3)的值为 。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(1)氨气是一种重要的化工原料,合成氨的原料气之一H2可通过反应:
CH4(g)+H2O(g) CO2(g)+3H2(g) △H=+161.1KJ/mol获取。已知温度、压强对甲烷平衡含量的影响如图1,请回答:
CO2(g)+3H2(g) △H=+161.1KJ/mol获取。已知温度、压强对甲烷平衡含量的影响如图1,请回答: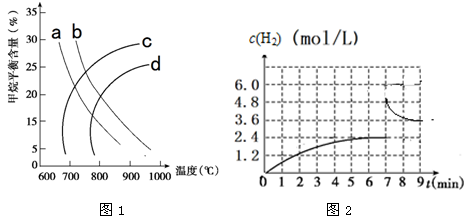
①图-1中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________。
②已知:在700 ℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,6min达到平衡(如图2),该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。
③从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是_________(填“向正反应方向”或“向逆反应方向”),采取的措施可能是_____________________。
(2)工业上用NH3和CO2反应可合成尿素:
2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g)△H1=—536.1 kJ/mol。
CO(NH2)2(g)+ H2O(g)△H1=—536.1 kJ/mol。
①其他条件不变,下列方法能同时提高化学反应速率和尿素产率的是 。
| A.通入氦气 | B.缩小体积 |
| C.加入催化剂 | D.除去体系中的水蒸气 |
②尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。
又知:4NH3(g)+ 6NO(g)= 5N2(g) + 6H2O(g) △H2=-1806.4 kJ/mol,
写出CO(NH2)2(g)与NO反应的热化学方程式 。
(3)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O。
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
从野菊花中可以提取一种具有降压、抗肿瘤作用的有机物绿原酸M,利用绿原酸M可合成两种医药中间体C和E,其合成路线如下(部分反应条件未注明):
已知:R—CH=CH—R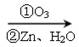 2R—CHO
2R—CHO
(1)M的分子式为______,1molM最多能与_____molNaOH反应;
(2)B中含氧官能团的名称是_______,C是一种芳香族化合物,其结构简式为________;
(3)由D生成E的化学方程式为________,反应类型是__________;
(4)E的同分异构体中含有苯环且遇氯化铁溶液显紫色的还有____种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为2:2:1:1的结构简式是___________;(任写一种)
(5)由乙苯经如下步骤可合成苯甲醇:
反应I所选用的试剂和反应条件为___________________________,如果F分子中不存在甲基,则反应2方程式为___________________________________________________________。
选考【化学-有机化学基础】以下是某化学兴趣小组为合成某药物设计的部分路线图(部分反应条件略去):
已知:
请根据要求回答下列问题:
(1)A分子中含有的官能团名称是_________(填名称)。
(2)下列关于C的说法正确的是 (填序号)。
a.分子式为C13H11O3
b.属于芳香族化合物
c.能发生取代、加成反应,但不能发生消去反应
d.C可能存在含有两个苯环的同分异构体
(3)X的结构简式为 ;
(4)D发生聚合反应生成的高聚物的结构简式为 ;
(5)合成药物时,中间产物E的结构如图。E在一定条件下催化氧化,生成物能发生银镜反应。该反应的化学方程式为 。
(6)满足下列条件的X的同分异构体有____种。
①遇氯化铁溶液显紫色;②能发生银镜反应