黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:
盐基度= × 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
(1)写出在酸性介质中用NaClO3氧化绿矾(FeSO4·7H2O)的离子方程式 。
(2)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度为 。
(3)计算出该固体聚合硫酸铁样品的化学式(x、y、z、n均取整数)为 。
今有七种物质: ①铝线 ②熔化的KNO3 ③NH3④NaCl晶体⑤液态氯化氢 ⑥石灰水 ⑦乙醇 ⑧二氧化碳,其中属于电解质的是 ,属于非电解质的是 ,上述状态下能导电的是
用反应的化学方程式表示下列几种常见离子的检验方法。
(1)NH4Cl中的NH4+检验 ;
(2)NaCl中的 Clˉ检验 ;
(3)K2SO4中的SO42ˉ检验 。
将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 3A(g)+B(g) xC(g)+2D(g),经过4min时,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,A在4 min末的浓度是___________,B的平均反应速率是______ __,x的值是 。
xC(g)+2D(g),经过4min时,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,A在4 min末的浓度是___________,B的平均反应速率是______ __,x的值是 。
(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为 ;
又知H2O(l)=H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ
(2)发射卫星时可用肼(N2H4)为燃料和NO2作氧化剂,这两者反应生成N2和水蒸气.又已知: ①N2(气)+2O2(气)=2NO2(气) △H=+67.7kJ/mol ②N2H4(气)+O2(气)=N2(气)+2H2O(气) △H=-534kJ/mol试写出肼与NO2反应的热化学方程式:
(3)甲烷燃料电池:碱性电解质(铂为两极、电解液KOH溶液)
正极:___________ _____
负极:__________
总反应方程式: CH4+ 2O2 + 2OH- = CO32- + 3H2O
电解原理在化学工业上有广泛应用。一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: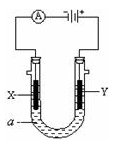
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。
①电解池中X极上的电极反应式为_________________,在X极附近观察到的现象是_______________。
②Y电极上的电极反应式为________________,检验该电极反应产物的方法是_______________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液
①X电极的材料是_________________,电极反应式为_______________。
②Y电极的材料是 ________________,电极反应式为________________。