下表表示的是元素周期表中短周期元素,根据要求回答下列问题:
| ⑧ |
|
|
|||||
| |
① |
|
② |
|
③ |
④ |
|
| ⑤ |
|
|
|
|
⑥ |
⑦ |
|
(1)④⑥元素气态氢化物的稳定性比较 > (写化学式)
(2)③号元素与其他元素可形成10个电子的阳离子和阴离子,其离子符号分别为 、 。
(3)用电子式表示⑧和③元素形成A2B型化合物的过程。
(4)用电子式表示⑤和⑥元素形成A2B型化合物的过程。
A、B、C、 D、E都是原子序数依次增大的五种短周期元素,已知:
①A和 C属同族元素,且A元素的原子半径是短周期元素原子中半径最小的;
②A和B能形成组成为A2B和A2B2的两种化合物;
③D元素原子所形成的离子在同周期元素原子形成的离子中半径是最小的;且D元素原子的最外层电子数是E元素原子最外层电子数的一半。
请回答:
(1)A元素是________;C元素是_________。D元素是_________。E元素是_________。(填元素符号)
(2)化合物A2B2的所含化学键______________电子式是____________;
(3)B和E形成两种常见化合物是_________和_________。
实验室通常以环已醇为原料在浓硫酸作用下脱水来制备环己烯。
W ww.k s5u.co m
|
氢气是重要而洁净的能源,要利用氢气作能源,必须安
全有效地储存氢气。
(1)某种铜镍合金材料有较大的储氢容量,
其晶体结构如图所示。这种合金中La与Ni
的原子个数比为;其中基态Ni
原子的核外电子排布式为。
(2)氢元素可与其他四种短周期元素a、b、c、d、e、f、g等七种微粒,它们都有10个电子,其填结构特点如下表:
| 微粒 |
a |
b |
c |
d |
e |
f |
g |
| 原子核数 |
双核 |
双核 |
三核 |
四核 |
四核 |
五核 |
五核 |
| 所带单位电荷 |
0 |
-1 |
0 |
0 |
+1 |
+1 |
①与c互为等电子体的一种阴离子是(填化学式);
②微粒中中心原子的杂化方式为杂化。
③比较相同条件下a与f在水中的溶解度:af(填“>”、“=”或“<”) ④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为。
④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为。
一氧化碳是一种重要的化工原料。
(1)高炉炼铁中发生的反应之一是:
 FeO(s)+CO(g) Fe(s)+CO2(g)△H=-1kJ/mol。
FeO(s)+CO(g) Fe(s)+CO2(g)△H=-1kJ/mol。
温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比将
(填“增大”、“减小”或“不变”)。
已知1100℃时,该反应平衡常数K=0.263,现测得高炉中(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时该反应.
A.向正反应向向进行 B.处于平衡状态 C.向逆反应方向进行
(2)合成氨工业中需将原料气中的CO变成CO2除去。在密闭密器中将CO和H2O混合加热到800℃,达到下列平衡:W ww.k s5u.co m CO(g)+H2O(g) CO2(g)+H2(g) K=1.0
CO(g)+H2O(g) CO2(g)+H2(g) K=1.0
若平衡时n(H2O)/n(CO)=1,则CO转化为CO2的转化率为。
(3)用CO和H2经如下两步反应制得甲酸甲醛:
CO+2H2→CH3OH
CO+CH3OH→HCOOCH2
已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则2.52;CO最多可制得甲酸甲醛多少吨?(写出计算过程)。
班布特罗是一种用于治疗小儿支气管哮喘的药物。它的合成路线如下(ph-表示苯基): 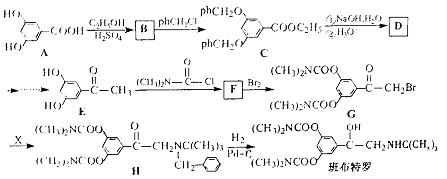
回答下列问题:
(1)A与过量的NaHCO 3溶液反应的化学方程式为 。
(2)F的结构简式为 。
(3)写出满足下列条件的E的一种同分异构体的结构简式 。
①苯的邻二取代物;
②不能与FeCl 4溶液发生显色反应;
③水解产物能发生银镜反应。
(4)由G与X(C 11H 17N)发生取代反应生成H,则X的结构简式为 。
|
|
(5)苯乙酸苯甲酯可用作花香型日用香精。请设计合理
方案以甲苯为原料合成苯乙酸苯甲酯(用合成路
线流程图表示,并注明反应条件), 。 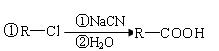
②合成过程中无机试剂任选;
③合成路线流程图示例如下: