(共8分)在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:
CO(g) + H2O(g)  CO2 + H2(g) ΔH< 0
CO2 + H2(g) ΔH< 0
已知CO的浓度变化如图所示。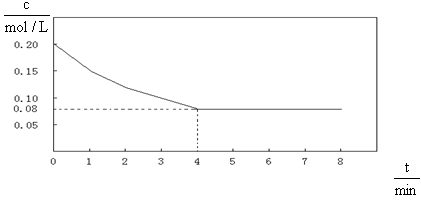
(1)从0~4 min,该反应的平均速率v(CO)= mol/(L·min)。该反
应的平衡常数为 。
(2)为了增大CO的转化率,可以采取的措施有 。
a.增大反应物中CO的浓度
b.降低反应温度
c.将密闭容器体积压缩至一半
d.加入适宜的催化剂
(3)若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水
蒸气的起始浓度至少为 。
4分)按要求写出相应的化学用语:
①甲基(电子式);②氢氧根(电子式);
4分)同系物是指:相似,在分子组成上相差原子团的化合物。
乙烯是一种重要的化工原料。根据下列转化关系回答: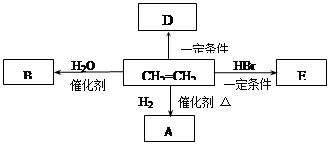
(1)乙烯分子中官能团的名称是。
(2)E的分子式是。
(3)乙烯转化成A的化学方程式是。
反应类型是。
(4)已知D是一种常见的高分子材料,写出它的结构简式
有下列几种物质:①HCl、②NH4Cl、③NaOH、④Cl2、⑤CO2、⑥H2O、⑦Na2O2。
(1)上述物质中,属于共价化合物的是(填序号,下同),既存在离子键又存在极性键的是
(2)④号物质的电子式为。
用电子式表示⑥号物质的形成过程:
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是(填编号)
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成和;不仅可以形成,还可以形成碳环。
(3)上图中互为同分异构体的是:A与;B与;D与。(填编号)