天然气中伴随有H2S等合硫化合物,脱硫方法有多种:
(1)一种湿法脱硫是用碳酸钾溶液吸收其中的H2S,同时生成两种酸式盐,该反应的化学方程为 。
(2)一种于法脱硫,其涉及反应:H2(g)+CO(g)+SO2(g)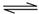 H2O(g)+CO2(g)+S(s)
H2O(g)+CO2(g)+S(s) 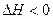 ,高脱硫率可采取的措施是 。
,高脱硫率可采取的措施是 。
a.高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出硫
(3)用脱硫剂ZDE—01的海绵铁法脱硫,可实现常温脱硫
①脱硫:Fe2O3·H2O(s)+3H2S(g)=Fe2S3·H2O(s)+3H2O(g) 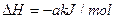
②再生:2Fe2S3·H2O(s)+3O2(g)=2Fe2O3·H2O(s) +6S(s)
+6S(s) 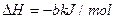
则2H2S(g)+O2(g)=2H2O(g)+2S(s) 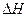 = (用a、b表示)
= (用a、b表示)
(4)一种改进的克劳斯法脱硫的工艺,化学反应如下 :
:
H3S+1.5O2=H2O+SO2 SO2+0.5O2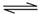 SO3
SO3
SO3(g)+H2O(g)=H2SO4(g) H2SO4(g)+0.17H2O(g)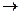 H2SO4(a
H2SO4(a q)
q)
该法最终得到的硫酸溶液的质量分数为 。
(选考)【化学——选修5:有机化学基础】A~G都是有机化合物,它们的转化关系如下:
请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6 g H2O;E的相对分子质量为60,则E的分子式为_______________;
(2)A为一元取代芳烃,B中含有一个甲基。由B生成C的化学方程式为________________________ ;
(3)由B生成D、由C生成D的反应条件分别是:________________、______________;
(4)由A生成B、由D生成G的反应类型分别是_______________、_____________;
(5)在G的同分异构体中,苯环上一硝化的产物只有一种,其中核磁共振氢谱有两组峰,且峰面积比为1:1的是_______________(填结构简式)。
(选考)【化学——选修物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式;
(2)B基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为 ,
,
该同学所画的电子排布图违背了
(4)G位于族区,价电子排布式为。
(5)DE3中心原子的杂化方式为,用价层电子对互斥理论推测其空间构型为。
(6)F元素的晶胞如图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为cm。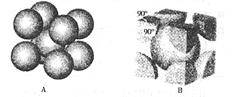
(15分)KMnO4是常用的强氧化剂,工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产,即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,简略生产过程如下:
(1)反应器中反应的化学方程式为:。
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、Si的氧化物含量较高,会导致KOH消耗量(填“偏高”或“偏低”),其中Al的氧化物和KOH溶液反应的化学方程式为:。
(3)电解槽中阳极的电极反应方程式为:;
(4)在传统工艺中得到K2MnO4后,向其中通入CO2制备KMnO4,化学反应方程式为:3K2MnO4+2CO2=2KMnO4+ MnO2+ 2K2CO3根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为。与该传统工艺相比,电解法的优势是。
(5)测定高锰酸钾样品纯度的方法是:向高锰酸钾溶液中滴加硫酸锰溶液产生黑色沉淀,反应的离子方程式。
(6)已知常温下KSP﹝Mn(OH)2﹞=2.0×10-23,工业上调节PH沉淀废水中的Mn2+,当pH=10时,
c(Mn2+)= mol/L。
水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子自身作用会生成阴、阳两种离子,其中阳离子的电子式是__________。
(2)室温时,在由水电离产生的c(H+)=1×10-14 mol·L-1的溶液中,
①NH4+、Al3+、Br-、SO42-
②Na+、Mg2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-
④K+、Na+、HCO3-、SO42-
四组离子中,一定可以大量共存的是_______(填序号,下同),可能大量共存的是_____________。
(3)在下列反应中属于氧化还原反应,水仅做氧化剂的是___________(填字母,下同),水既不做氧化剂又不做还原剂的是_______________。
A.CaO+H2O====Ca(OH)2
B.2Na2O2+2H2O====4NaOH+O2↑
C.2F2+2H2O====4HF+O2
D.3Fe+4H2O(g)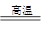 Fe3O4+4H2
Fe3O4+4H2
(4)已知铅蓄电池的反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O,
2PbSO4+2H2O,
①下列分析错误的是_____________。
A.铅蓄电池是最常用的可充电电池,在充电时,电池的正极应接直流电源的正极
B.铅蓄电池在放电时,电解液的酸性减弱
C.铅蓄电池在放电时,PbO2作为负极,不断转化为PbSO4
D.铅蓄电池在充电时,PbO2是氧化产物
②用该铅蓄电池电解1.8 mL水,电池内转移的电子数约为_________,消耗__________ mol硫酸。
(5)如图是某品牌饮用矿泉水标签的部分内容。
请认真阅读标签内容后计算。
①该矿泉水中镁离子的物质的量浓度的最大值是____;
②一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过___________mol。
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇KSCN溶液呈红色。
请回答下列问题:
(1)Y的最高价氧化物对应水化物的化学式是____________________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式____________。
此液体具有的性质是____________(填字母)。
| A.光束通过该液体时形成光亮的“通路” |
| B.插入电极通直流电后,有一极附近液体颜色加深 |
| C.向该液体中加入硝酸银溶液,无沉淀产生 |
| D.将该液体加热、蒸干、灼烧后,有氧化物生成 |
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率__________。
②原无色有刺激性气味的气体与含1.5 mol Y的含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应。可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是(用单线桥表示电子转移方向和数目):_____________________________________________。
(4)室温时,pH=5的HY溶液和pH=5的ZY3溶液中,水电离出的氢离子分别是mol·L-1和
mol·L-1