工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子是Cd2+,所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
| 溶解度/g |
41.8 |
54.1 |
70.4 |
74.8 |
67.2 |
60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
"张-烯炔环异构反应"被《
》收录。该反应可高效构筑五元环化合物:
(
表示氢、烷基或芳基)
合成五元环有机化合物
的路线如下:
(1)
属于炔烃,其结构简式是。
(2)
由碳、氢、氧三种元素组成,相对分子质量是30。
的结构简式是
(3) 含有与 相同的官能团, 是芳香族化合物, 中含有的官能团是
(4) 与试剂 反应生成 的化学方程式是 ;试剂 是。
(5) 和 均为不饱和醇。 的结构简式是
(6) 为顺式结构,写出 和 生成I(顺式结构)的化学方程式:。
科学家正在研究温室气体
和
的转化和利用。
(1)
和
所含的三种元素电负性从小到大的顺序为。
(2)下列关于
和
的说法正确的是(填序号)。
a.固态
属于分子晶体
b.
分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以
熔点低于
d. 和 分子中碳原子的杂化类型分别是 和
(3)在
基催化剂作用下,
和
反应可获得化工原料
和
.
①基态
原子的电子排布式为,该元素位于元素周期表的第族。
②
能与
形成正四面体形的配合物
,1
中含有
键。
(4)一定条件下,
和
都能与
形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。
与
形成的水合物俗称"可燃冰"。 
①"可燃冰"中分子间存在的2种作用力是。
②为开采深海海底的"可燃冰",有科学家提出用
置换
的设想。已知上图中笼状结构的空腔直径为0.586
,根据上述图表,从物质结构及性质的角度分析,该设想的依据是。
是常见的六种元素。
(1)
位于元素周期表第周期第族。
(2)
的基态原子核外电子排布式为;
的基态原子最外层有个电子。
(3)用">"或"<"填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| 金刚石晶体硅 |
|
(4)常温下,将除去表面氧化膜的
、
片插入浓
中组成原电池(图1),测得原电池的电流强度(
)随时间(
)的变化如图2所示,反应过程中有红棕色气体产生。 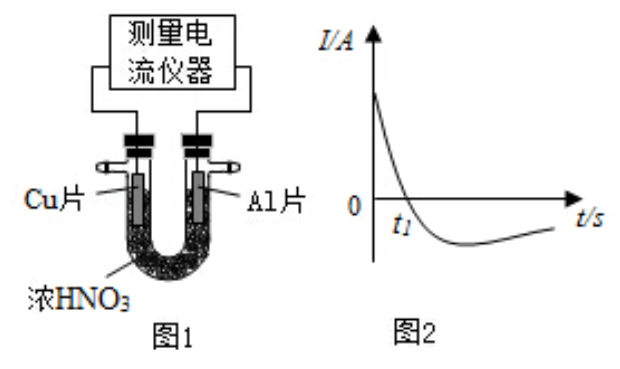
0- 时,原电池的负极是 片,此时,正极的电极反应式是,溶液中的 向极移动, 时,原电池中电子流动方向发生改变,其原因是。
(15分)乙苯催化脱氢制苯乙烯反应: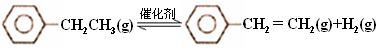
(1)已知:
| 化学键 |
||||
| 键能/ | 412 |
348 |
612 |
436 |
计算上述反应的
=
。
(2)维持体系总压强
恒定,在温度
时,物质的量为
、体积为
的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为
,则在该温度下反应的平衡常数
=(用
等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了
以外的产物中苯乙烯的物质的量分数)示意图如下: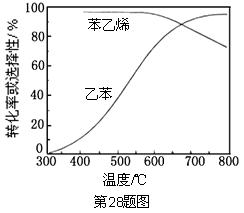
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实。
②控制反应温度为600℃的理由是。
(4)某研究机构用
代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:
,
。新工艺的特点有(填编号)。
①
与
反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于
资源利用
Ⅰ.请回答:
(1)
的电子式。
(2)镁燃烧不能用
灭火,用化学方程式表示其理由。
(3)在
沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式。
(4)完成以下氧化还原反应的离子方程式:
(___)
+(___)
+____=(___)
+(___)
↑+
Ⅱ.化合物甲和
都是重要的还原剂。一定条件下金属钠和
反应生成甲。甲与水反应可产生
,甲与
反应可得到
。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的
。
请推测并回答:
(1)甲的化学式。
(2)甲与
反应得到
的化学方程式。
(3)
与水发生氧化还原反应的化学方程式。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为
),脱锈过程发生反应的化学方程式。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生
,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由。