五羧基全铁[Fe(CO)5]是一种浅黄色液体,熔点-20.5℃,沸点103℃,易溶于苯 等有机溶剂,不溶于水,密度1.46—1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃,可用着汽油抗爆剂,催化剂等。五羰基合铁的制备原理如下:
等有机溶剂,不溶于水,密度1.46—1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃,可用着汽油抗爆剂,催化剂等。五羰基合铁的制备原理如下:
(1)五碳基合铁中铁的化合价为 。
(2)下列说法正确的是 。
| A.利用上述反应原理可制备高纯铁 |
| B.制备Fe(CO)5应在隔绝空气的条件下进行 |
C.反应Fe(s)+5CO(g)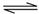 Fe(CO)5(g)的平衡常数表达式为 Fe(CO)5(g)的平衡常数表达式为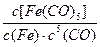 |
| D.Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存。 |
(3)五碳基合铁能与氢氧化钠溶液反应生成Na2Fe(CO)4和另两种常见无机物,该反应的化学方程式为 。
(4)今将一定量的Fe(CO)5的苯溶液,用紫外线照射片颏。取照射后的 溶液11.72g完全燃烧,得到30.536gCO2、5.4gH2O及1.6g红棕色粉末。
溶液11.72g完全燃烧,得到30.536gCO2、5.4gH2O及1.6g红棕色粉末。
①红棕色粉末的化学式为 。
②照射后的溶液中Fe(CO)5与Fe2(CO)9的物质的量之比为  。
。
工业制备氯化铜时,将浓盐酸用蒸气加热到80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?______,理由是_____________________。
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是___________(填序号);
A.一定增大B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?__________,理由是____________________________。
③现有下列几种常用的氧化剂,可用于除去该混合溶液中Fe2+的有_________(填序号)。
A.浓HNO3B.KMnO4C.Cl2D.O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有__________(填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3D.Na2CO3
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:
负极的电极反应式是;
正极的电极反应式是。
(3)下图是一个电化学过程示意图。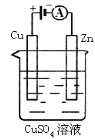
①锌片上发生的电极反应是。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是。
某二元弱酸(简写为H2A)溶液,按下式发生一级或二级电离:
H2A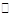 H++HA-,HA-
H++HA-,HA-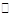 H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A、0.01mol/L的H2A溶液
B、0.01mol/L的NaHA溶液
C、0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合
D、0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合
据此,填写下列空白(填代号):
(1)c(H+)最大的是,最小的是;
(2)c(H2A)最大的是,最小的是;
(3)c(A2-)最大的是,最小的是。
现有如下两个反应:
A、NaOH + HCl =" NaCl" + H2O
B、2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质, 判断能否设计成原电池:A、_________,B、__________(选择“能”或“不能”);
(2)如果不能,说明其原因___________________________________________;
(3)如果可以,则写出正、负极材料及其电极反应式, 电解质溶液:
负极材料________,电极反应式_______________,电解质溶液____________;
正极材料________,电极反应式_______________。
(共10分前2个空每空一个1分,其余每空2分)依据氧化还原反应2Ag+(aq)+Cu(s) ="===" Cu2+(aq)+2Ag(s)设计的原电池如图所示: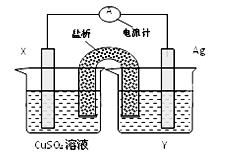
请回答下列问题:
(1)外电路中的电子是从_______ 电极流向________电极。
(2)银电极发生的电极反应为________________________;
X电极上发生的电极反应为___________________________;
(3)LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2==="4LiCl" +S +SO2↑。请回答下列问题:
写出电池的负极发生的电极反应为_________________________________________;
电池正极发生的电极反应为______________________________________;