氧化还原反应在工农业生产和日常生活中有广泛的应用。
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动。反应为:C6H12O6+6O2=6CO2+6H2O+能量,该反应中的还原剂是 。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有 (填“氧化性”或“还原性”)
(每空2分,共14分)下图为以惰性电极进行电解:
(1)写出A、B、C、D各电极上的电极方程式:
A________________________________
B________________________________
C________________________________
D________________________________
(2)在A、B、C、D各电极上析出生成物的物质的量比为。
(3)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOHb.Zn c.Fed.NH3·H2O
有A、B、C、D、E四种短周期元素,原子序数依次增大,在周期表中B与C相邻、D与E相邻。已知A原子的电子层数与它的核外电子总数相同。B元素的氢化物与E元素的氢化物反应只生成一种盐;C、D位于同一族,它们能组成DC2、DC3两种常见化合物。请回答下列问题:
(1)C是________,D是____________,E是____________(填元素名称)。
(2)由A、B、C中的两种元素组成,且与A2C分子具有相同电子数的两种阳离子是________和________(写化学式)。
(3)D与E可形成共价化合物D2E2,分子中D与E均满足8电子稳定结构,则D2E2的电子式为_______。
(4)A、B、C可以形成一种盐,此盐中A、B、C元素的原子的个数比为4:2:3,该盐的化学式是____________。该盐受热可产生B的单质和B的最高价氧化物的水化物,对应化学方程式是____________。
(5)A、B可以形成一种离子化合物,电子式是____________
(10分)已知10.4 g某有机物X在空气中完全燃烧,所得产物先后通过足量的浓硫酸和碱石灰,分别增重7.2克和35.2克。物质X在不同条件下能发生如下图所示的一系列变化。
注:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物)
(1)X的化学式:________,X的结构简式:________ ,C的结构简式:。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出D―→E反应的化学方程式。
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)基态Cu2+的核外电子排布式为。
(2)根据价层电子对互斥模型(VSEPR),PO43-离子内中心原子价层成键电子对和孤电子对之和为,离子的空间构型是。
(3)液氨分子间存在自耦电离:2NH3 NH2-+NH4+,NH2-中氮原子轨道的杂化类型是,H+易与NH3形成NH4+,配位键的解释是。
NH2-+NH4+,NH2-中氮原子轨道的杂化类型是,H+易与NH3形成NH4+,配位键的解释是。
(4) 胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有。(填序号)
胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有。(填序号)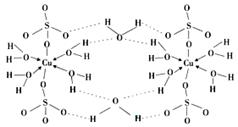
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,Cu2+的配位数为,1mol CN-中含有的π键的数目为。
化合物C是某合成路线的中间体,可通过下列方法合成:
回答下列问题:
(1)在催化剂作用下,A与氢气反应的化学方程式为,反应类型为。
(2)B的结构简式为,所得B的粗产品通常用的方法提纯。
(3)在C的制备中,浓硫酸的作用是。