下列溶液中有关物质的量浓度关系和计算不正确的是 ( )
| A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3) <c(CH3COONa) |
B.已知25°C时 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 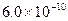 mol·L-1 mol·L-1 |
| C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶 液中水电离出来的OH-浓度 |
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有 |
纳米钴(Co)常用于CO加氢反应的催化剂,500 K时有催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
| A.纳米技术的应用,提高了催化剂的催化性能 |
| B.缩小容器体积,平衡向正反应方向移动,CO的浓度减小 |
| C.温度越低,越有利于CO催化加氢 |
| D.从平衡体系中分离出H2O(g)能加快正反应速率 |
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq) I3—(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
I3—(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
某温度下,向容积为2 L的密闭反应器中充入0.10 mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g) 2SO3(g)的平衡常数为( )
2SO3(g)的平衡常数为( )
| A.3.2×103 | B.1.6×103 | C.8.0×102 | D.4.0×102 |
某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )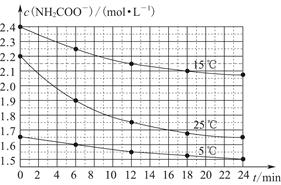
| A.0~12 min,初始浓度越大的实验,水解反应速率越大 |
| B.c(NH2COO-)将随反应时间的不断延长而一直减小至0 |
| C.25 ℃时0~6 min,v(NH2COO-)为0. 05 mol·L-1·min-1 |
| D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1 |
在容积为2 L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)反应时间t的变化曲线如图所示,下列说法正确的是( )
CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)反应时间t的变化曲线如图所示,下列说法正确的是( )
| A.该反应的ΔH>0 |
B.其他条件不变,升高温度反应的平衡常数增大 |
C.300 ℃时,0~t1 min内 CH3OH的平均生成速率为 mol·L-1·min-1 mol·L-1·min-1 |
D.A点的反应体系从300 ℃升高到500 ℃,达到平衡时 减小 减小 |