I.(1)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+ KIO3+ H2SO4—— Na2SO4+ K2SO4+ I2+ H2O
①配平上面的氧化还原反应方程式,将计量数填在方框内。
②其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘是 mol。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,乙硼烷燃烧热的热化学方程式为 。
II.含氰化物(有CN-)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒 杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
(1)二氧化钛在上述反应中的作用是 。
(2)CNO-经进一步处理后产生的两种无毒气体应该是 和 。
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为 。
KHSO4溶于水或熔化时都会存在的离子是_____________。
下列物质中,属于强电解质的是(),属于弱电解质的是(),属于非电解质的是()。
A碘化钾;B乙醇;C氨气;D蔗糖;E氢硫酸;F硫酸氢钠;G氨水;H液氧;I氢氧化钠溶液
健康人血液中的pH保持在一定范围内变化,这是因为血液中存在如下平衡:H2CO3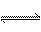
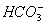 +H+,医学上称为血液酸碱平衡,试解答下列问题:
+H+,医学上称为血液酸碱平衡,试解答下列问题:
(1)蚊虫、蚂蚁等昆虫叮咬人时常向人体血液内注入一种称之为蚁酸(主要成分为HCOOH)的有机酸,HCOOH同CH3COOH一样是一种有机弱酸,写出HCOOH在溶液中电离的方程式:___________________________________。
(2)当人受到蚂蚁叮咬时皮肤上常起小疱,这是因为人体血液中酸碱平衡被破坏所致,若不看医生治疗,过一段时间小疱也会自行痊愈,这是由于血液中又恢复了原先的酸碱平衡,试用平衡移动原理解释上述事实:_____________________________________________________。
有A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,并按图所示方式在电路中连接。闭合开关K后,测得各支路电流强度ⅠⅠ≈ⅠⅡ(其中ⅠⅡ略小)。 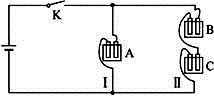
若撤去B,测知电流强度ⅠA<<ⅠC;若撤去C,并将A、B两溶液混匀后均分为两等份,再重置于电路Ⅰ、Ⅱ处,测知通过A、B混合溶液的电流强度与先前通过A溶液的电流强度的相对大小关系为:ⅠsAB>>ⅠA
已知A、B、C分别选自下列溶液:
①0.1 mol·L-1盐酸 ②0.1 mol·L-1醋酸 ③0.1 mol·L-1NaCl溶液 ④0.1 mol·L-1硫酸 ⑤0.1 mol·L-1 NaOH溶液 ⑥0.1 mol·L-1氨水,且25 ℃时,A溶液pH<7
回答下列问题:
(1)指出A、B、C是(或可能是)什么溶液?
A____________;B____________;C____________。
(2)若向C溶液中滴入酚酞试剂呈红色,则C是____________。将A、B、C分别以等体积进行两两混合,结果是哪种组合的混合液中,水的电离程度最大? ____________。(选填“A”“B”“C”)
Al(OH)3的电离方程式可表示为:H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
(1)向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是________________________,有关的离子方程式为________________________。
(2)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是________________________,有关的离子方程式为________________________。