(Ⅰ)有一包白色粉末,可能含有NaHSO4 KHCO3 Ba(NO3)2 CaCl2 NaNO3 MgSO4 中的一种或几种。
(1)取少量粉末投入水中,既有气体又有沉淀产生;
(2)过滤,取少量滤液,加入AgNO3溶液,无沉淀产生;
(3)再取少量滤液,加入NaOH溶液,也无沉淀产生。
推断白色粉末中一定有_______ ,一定没有_______,不能肯定有没有的是
________。
(Ⅱ)现有A、B、C、D、E五种盐溶液,分别由K+、NH4+、Ag+、Ba2+、 Al3+、Cl-、Br-、CO32-、SO42-、NO3-中的阳离子与阴离子各一种组成(五种盐所含阴、阳离子各不相同)。
已知:①A+B→白↓;②A+C→白↓;③A+D→白↓;④B+C+H2O→白↓+气体;⑤A的溶液呈中性;⑥B的溶液中c(OH-)>c(H+);⑦C、D、E三种溶液的pH<7.根据以上事实,回答下列问题:
⑴写出化学式:C D E
⑵用离子方程式表示:B的溶液中c(OH-)>c(H+)的原因。
合成氨工业的核心反应是N2(g)+3H2(g)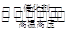 2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题。
2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题。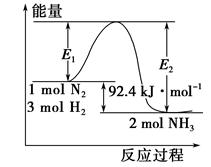
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化:E1________,E2________(填“增大”、“减小”或“不变”)。
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量________(填“<”、“>”或“=”)46.2 kJ,理由是____________________________________________________________。
(10分)氯气在298 K、100 kPa时,在1 L水中可溶解0.090 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为______________________________________;
(2)在上述平衡体系中加入少量NaCl固体,平衡将向________移动(填“正反应方向”、“逆反应方向”或“不”)。
(3)如果增大氯气的压强,氯气在水中的溶解度将________(填“增大”、“减小”或“不变”),平衡将向________移动。(填“正反应方向”、“逆反应方向”或“不”)
(4)在饱和氯水中加入石灰石可得到较大浓度的次氯酸溶液,请运用学过的化学原理进行解释(次氯酸、碳酸的平衡常数分别为:K=3×10-8、K1=4.4×10-7):
;写出氯水与石灰石反应的离子方程式:。
(8分)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.反应A中,1 mol HCl被氧化,放出28.9 kJ的热量。
ⅱ.
(1)反应A的热化学方程式是。
(2)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)。
(3)大气中的部分碘源于O3对海水中I-的氧化。O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g) IO-(aq)+O2(g) ΔH1
IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HIO(aq) ΔH2
HIO(aq) ΔH2
③HIO(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为,其反应热ΔH=。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为mol·L-1·s-1反应的平衡常数K1=。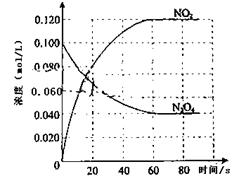
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是。
②温度T时反应的平衡常数K2 =
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向(填“正反应”或“逆反应”)方向移动,判断的理由是:。
(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是:。
(8分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是、。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是。
(3)他们记录的实验数据如下:
| 实验用品 |
溶液温度 |
中和热 |
|||
| T1 |
t2 |
ΔH |
|||
| ① |
50 mL0.55 mol·L-1 NaOH溶液 |
50 mL0.5 mol·L-1 HCl溶液 |
20 ℃ |
23.3 ℃ |
|
| ② |
50 mL0.55 mol·L-1 NaOH溶液 |
50 mL0.5 mol·L-1 HCl溶液 |
20 ℃ |
23.5 ℃ |
(已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。)
根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:。
(4)若用KOH代替NaOH,对测定结果(填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果(填“有”或“无”)影响。