储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、Cr2(SO4)3、H2O七种物质。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,所具的性质有
①丁达尔效应 ②加入饱和(NH4)2SO4溶液产生聚沉 ③可通过半透膜
(2)请用上述物质填空,并配平化学方程式:
C+ + H2SO4→ K2SO4+ + Cr2(SO4)3+ H2O
(3)H2SO4在上述反应中表现出来的性质是(填选项编号) 。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为 。
(5)若将一定量的上述气体通入含0.1molNaOH的溶液中,小心加热蒸干,可得7.16g固体,则在加热前溶液中离子浓度的大小关系是 。
在一定温度下,将3molA和1molB两种气 体混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+ B(g)
体混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+ B(g)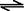 XC(g)+2D(g),2min末反应达到平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
XC(g)+2D(g),2min末反应达到平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)、X值等于
(2)、B的平衡浓度为
(3)、达平衡状态时,A的转化率为
(4)、2min内,生成D的平均反应速率为
(5)、如果增大反应体系的压强,则平衡体系中C的质量分数(填:“增大” 、“减小” 或“不变” )。
(6)、若升高温度后,D的体积分数减小,则正反应为(填“放热”或“吸热”)反应。
(15分)
近期研究证实,中药甘草中的异甘草素在药理实验中显示明显的促进癌细胞凋亡和抑制肿瘤细胞增殖的活性,且对正常细胞的毒性低于癌细胞。异甘草素可以由有机物A和有机物B合成(A、B均为芳香族含氧衍生物),且由A和B合成异甘草素要用到以下反应:
请回答下列问题:
⑴有机物B分子式为C7H6O2,A和B均能与浓溴水反应生成沉淀。A和B具有一种相同的含氧官能团,其名称为;B的核磁共振氢谱有四个峰,峰面积之比是2:2:1:1。以下说法正确的是(填序号)。
①有机物B能发生很多类型的反应,例如:中和、取代、氧化、还原、加成反应
②与B互为同分异构体的芳香族含氧衍生物共有两种(不含B)
③B能与碳酸氢钠溶液反应放出二氧化碳气体
⑵质谱表明有机物A相对分子质量为152,其碳、氢、氧元素的质量分数比为12:1:6。有机物A的分子式为;已知A分子中的官能团均处于间位,写出A、合成异甘草素的化学方程式。
⑶初步合成的异甘草素需要经过以下处理工艺;
I加入一定量的水,再加入一定量的乙醚提取2次 II用无水MgSO4干燥、过滤减压蒸出。 III洗涤、浓缩得黄色粉末,再用含水乙醇处理得黄色针状晶体。
步骤II蒸出的物质可能是。以上处理工艺中涉及的分离提纯操作依次有。
⑷有机物D符合下列条件,写出D的结构简式。
①与A互为同分异构体,且能发生水解反应②1molD能与3moNaOH反应
③苯环上的氢被氯取代的一氯代物有两种
⑸有机物B还可以发生以下变化: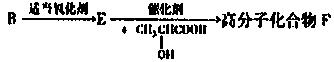
已知:F的单体是由E和CH3CHCOOH按1:1生成,请写出E→高分子化合物F的化学方程式。
(15分)微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
⑴基态G原子的外围电子排布式是。在A、B、C这三种分子中,属于非极性分子的有(写化学式)。
⑵下列有关B的说法中正确的是。(填字母)
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1 molB的液体中有3mol氢键
⑶根据等电子体原理,D离子的空间构型是,其中心原子轨道的杂化类型是。
⑷构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,上图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子。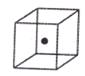
⑸光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.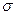 键 h.
键 h. 键
键
(15分)
硫酸工厂排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前必需进行尾气处理并设法进行综合利用。
⑴硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程的化学反应方程式:,
②请说出这种尾气处理方法的优点(说出两点即可)
③若某硫酸厂每天排放的1万米3。(标准状况)尾气中含0.2%(体积百分数)的SO2,通过上述方法处理,理论上需生石灰kg。
⑵近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,该方法:第一步是用Na2SO3水溶液吸收SO2,第二步是加热吸收溶液,可得到含高浓度SO2的水蒸气副产品。
这种尾气处理方法与(1)相比的优点是。
⑶某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法;其中阴阳膜组合循环再生机理如图,a、b离子交换膜将电解槽分为三个。区域,电极材料为石墨。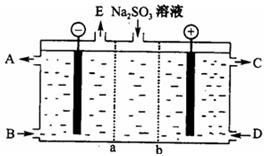
①图中a表示离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品,其中C为硫酸,则A表示,E表示。
②阳极的电极反应式为。
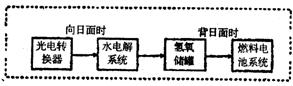
I.我国即将建成自己的载人空间站。载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。
⑴某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的某极反应为:4OH--4e-=O2↑+2H2O,则另一极反应为:。
⑵有人提出,可以设计某温度下的反应:2CO=2C+O2(△H>O、△S<O)来消除CO的污染。请你判断该温度下上述反应是否能发生并说明理由是。
Ⅱ.大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致力“人工固氮”新方法的研究。
⑴有关大气固氮(以N2+O2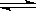 2NO为例)、人工固氮(以N2+3H2
2NO为例)、人工固氮(以N2+3H2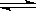 2NH3为例)反应的平衡常数
2NH3为例)反应的平衡常数 的值如下表。
的值如下表。
| 反应 |
N2+02 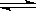 2NO 2NO |
N2+3H2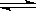 2NH3 2NH3 |
||
| 温度/℃ |
27 |
2000 |
100 |
400 |
| K |
3.84×10-31 |
0.1 |
3.4×109 |
2.0x104 |
下列说法正确的是。(填字母)
a.大气固氮与人工固氮都是放热反应
b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
⑵已知:N2(g)+3H2(g) 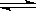 2NH3(g)
2NH3(g)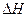 =-92.4kJ·mol-1
=-92.4kJ·mol-1
2H2(g)+02(g)="2H20(1)" 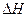 ="-571.6" kJ·mol-1
="-571.6" kJ·mol-1
据报道,在常温、常压、光照、催化剂的条件下,N2可以与水反应,则反应 N2(g)+3H20(1)=2NH3(g)+3/2O2(g)的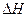 =KJ·mol-1。
=KJ·mol-1。
⑶某研究小组在673 K、30 MPa下,在体积为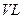 的密闭容器中进行反应:N2(g)+3H2(g)
的密闭容器中进行反应:N2(g)+3H2(g) 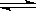 2NH3(g),其
2NH3(g),其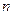 (H2)和
(H2)和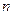 (NH3)随时间变化的关系如图所示。
(NH3)随时间变化的关系如图所示。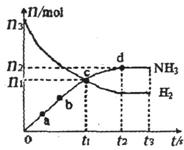
①下列叙述正确的是。(填字母)
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若t3时由673 K升至773 K,则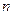 (H2)将增大
(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示)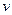 (H2)=。
(H2)=。
③若开始时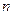 (N2)=
(N2)=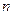 (H2),则反应的平衡常数
(H2),则反应的平衡常数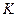 =(用代数式表示)。
=(用代数式表示)。