科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3h):
| T/K |
303 |
313 |
323 |
353 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(l)====2NH3(g)+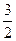 O2(g) ΔH
O2(g) ΔH =+765.2kJ·mol-1
=+765.2kJ·mol-1
回答下列问题:
(1)右图是上述反应在无催化剂情况下反应过程中体系能量变化示意图,请在图中画出在有催化剂情况下反应过程中体系能量变化示意图。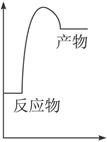
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为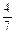 。计算
。计算
①该条件下N2的平衡转化率是 ;
②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数为
N2(g)+3H2(g)的平衡常数为  。
。
③若温度不变,减小容器体积,则平衡向---------------------------移动,c(NH3)将--------------------
c(N2)将----------------------(填增大、减小或不变)
Ⅰ 浓度为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+)依次为a mol·L-1,b mol·L-1,c mol·L-1,其由大到小的顺序是________。
(2)完全中和一定量NaOH溶液时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为__________________________________。
(3)与锌反应开始时产生氢气的速率分别为v1、v2、v3,其由大到小的顺序是________。
Ⅱ c(H+)相同的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液均加水稀释至体积为原来的10倍, c(H+)依次为a mol·L-1,b mol·L-1,c mol·L-1,其由大到小的顺序是_______。
(2)三种溶液体积相同时,同时加入相同的锌,若产生相同物质的量的氢气,所需时间分别为t1、t2、t3,其大小关系是___________.
(1)某温度(T℃)时,测得0.01 mol/L NaOH溶液的pH为11,则该温度下水的KW=________。则该温度________(填“大于”、“小于”或“等于”)25℃,其理由是___________________________________________________。
(2)此温度下,将pH=a的NaOH溶液Va L与pH=b的HCl溶液Vb L混合,若所得混合溶液为中性,且a=12,b=2,则Va∶Vb=________。
下面所列物质中,属于电解质的是__________(填序号,下同),属于非电解质的是________,属于强电解质的是__________,属于弱电解质的是________。
①CH3CH2OH ②CH3COOH ③熔融态KNO3 ④SO3 ⑤蔗糖 ⑥HF ⑦NaHCO3 ⑧氨水 ⑨Cl2 ⑩BaSO4 ⑪Cu
下表列出了①~⑥六中元素在周期表中的位置:
族 周期 周期 |
ⅠA |
0 |
||||||
| 1 |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
请按要求回答下列问题:
(1)写出下列标号元素的元素符号:①、⑤ 。
(2)④和⑥两种元素形成的化合物的电子式是。
(3)元素②形成的最简单有机物的空间结构为。
(4)元素④的单质在氧气中燃烧的化学方程式是。
(10分)(1)物质的量各为1mol的钠、镁、铝与1mol·L-1的盐酸100mL反应,在相同条件下产生氢气的体积之比是______。等物质的量的Na2CO3和NaHCO3与足量的盐酸反应,在相同条件下产生二氧化碳的体积之比是__________。
(2)除去FeCl2溶液中少量的FeCl3最好加入_________物质,离子方程式为_____________。
除去SO2气体中少量的HCl最好加入_________物质,离子方程式为________________。
(3)鉴别Na2CO3和NaHCO3溶液可选用_________。(填序号)①CaCl2 ②Ca(OH)2 ③BaCl2
(4)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是____________。(填序号)
① NaAlO2 ②(NH4)2CO3 ③Na2CO3 ④Al(OH)3⑤Ca(OH)2 ⑥NaHSO3