现有四种系列同族元素形成的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示,
| ① |
He -268.8 |
Ne -249.5 |
Ar (x) |
Kr -151.7 |
| ② |
F2 -187.0 |
Cl2 -33.6 |
(a) 58.7 |
I2 184.0 |
| ③ |
HF (y) |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
| ④ |
H2O (z) |
H2S -60.2 |
(b) -42.0 |
H2Te -1.8 |
试根据上表回答下列问题
(1)a为____________色液体;b的分子式为_______________。
(2)写出②系列中物质主要化学性质的递变规律(任写一种)_______ _____
____________________;能够说明该递变规律的化学事实是_________________________
(任举一例,用离子方程式表示)。
3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是___________________________________________________________________。
(4)上表中,______和______两种物质的沸点较同系 列其它物质反常,反常的主要原因是__
列其它物质反常,反常的主要原因是__
___________________________________________________________________________。
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):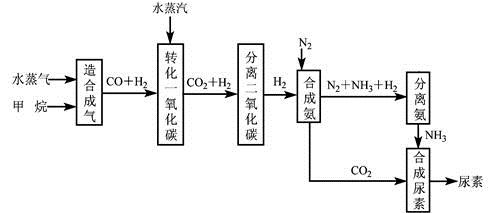
填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是。
(2)上述流程中,工业上分离H2 、CO2合理的方法是。
A混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B混合气加压冷却,使CO2液化
C混合气用氨水洗涤
D混合气先通入到石灰浆,然后高温煅烧固体,
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行,目的是____________________;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,阐述图中的两处可以合理利用资源情况。
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备。请回答下列问题:
(1)O、S、Se的电负性最小的是,它们的氢化物中沸点由高到低的顺序是(用化学式表示)。
(2)硒的低价含氧酸盐—亚硒酸钠(Na2SeO3),能促进细胞DNA的增殖活性,延缓细胞衰老,SeO32-中的Se原子杂化方式是,空间构型为;
(3)镉(Cd)与锌为同族相邻元素,在周期表中Cd位于区,Cd 的最外层电子排布图是。
(4)锌单质晶体是六方最密堆积,原子按(填“ABABAB”或“ABCABCABC”)的方式堆积而成,晶体中Zn原子的配位数为,锌易与某些小分子物质形成配合物,在[Zn(NH3)4]2+离子中提供孤电子对的原子是(填元素符号)。
(5)镉和锌都是电的良导体,非金属晶体石墨也具有良好的导电性,下图为石墨晶体结构示意图及提供的资料,12g石墨晶体中正六边形的数目为,石墨的密度为g·cm-3。(阿伏加德罗常数为NA)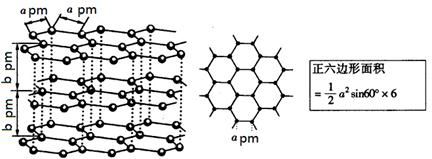
有机物A、B的分子式均为C10H10O5,均能发生如下变化。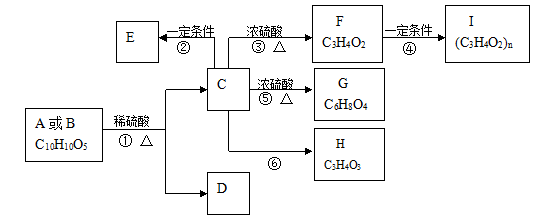
已知:
①A、B、C、D等均能与NaHCO3反应
②只有A、D能与FeCl3溶液发生显色反应,A苯环上的一溴代物只有两种
③F能使溴水褪色,
④H不能发生银镜反应
根据题意回答下列问题:
(1)反应③的反应类型是;有机物F含氧官能团的名称是;
(2)写出有机物的结构简式D、H;
(3)写出反应⑤的化学方程式;
(4)D的同分异构体有很多种,写出同时满足下列要求的所有同分异构体的结构简式;
①能与FeCl3溶液发生显色反应
②能发生银镜反应但不能水解
③苯环上的一卤代物只有2种
煤是重要的能源,也是化工生产的重要原料。
(1)煤燃烧产生的废气直接排放到空气中,可能导致的环境污染问题是_______。
(2)下图是对煤矿燃烧产生的废气进行常温脱硫处理的流程示意图。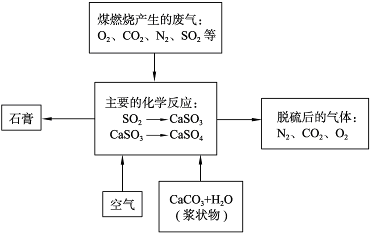
①废气脱硫过程中,主要反应的化学方程式为______________、_____________;
②在煤矿中直接添加一种物质,可有效减少煤矿燃烧产生的SO2,该物质是___;
③石膏的工业生产中的用途是_________________(写出一种用途即可)。
(3)煤经过___________(填加工方法)可以得到焦炉煤气、煤矿焦油和焦炭。煤焦油经过_______(填加工方法)可得到芳得族化合物。煤矿也可以用氢化法转化燃油,氢化法的本质是______________。
(4)煤可以液化转化为CH3OH,有人设计出在KOH溶液中用电极表面镀一层细小的铂粉做电极,铂吸附气体的能力强,性质稳定,利用CH3OH和O2构成的燃料电池的能量转化主要形式是 ,负极反应式为 ,电极表面镀铂粉的原因为 。
物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_______________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的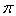 键有________mol。
键有________mol。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金化学式为;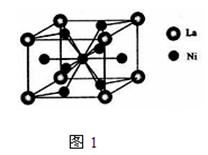
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟Ni2+反应可生成鲜红色沉淀,其结构如图2所示: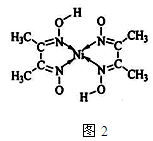
①该结构中,碳碳之间共价键是σ键,碳氮之间共价键是,氮镍之间形成化学键是;
②该结构中,氧氢之间除共价键外还可存在;
③该结构中,碳原子杂化轨道有