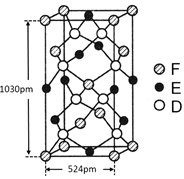
物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_______________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的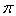 键有________mol。
键有________mol。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金化学式为 ;
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟Ni2+反应可生成鲜红色沉淀,其结构如图2所示: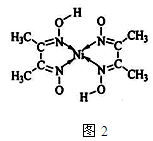
①该结构中,碳碳之间共价键是σ键,碳氮之间共价键是 ,氮镍之间形成化学键是 ;
②该结构中,氧氢之间除共价键外还可存在 ;
③该结构中,碳原子杂化轨道有
煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳。然后是使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的化学方程式为:
a.C(s)+ O2(g) = CO2(g)△H=E1①
b.C(s) + H2O(g) = CO(g)+ H2(g)△H=E2②
H2(g)+ 1/2 O2(g) = H2O(g)△H=E3③
CO(g)+ 1/2 O2(g) = CO2(g)△H=E4④
回答:
(1)与途径a相比,途径b有较多的优点,即________________________
(2)上述四个热化学方程式中哪个反应△H >0?________________
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
A、a比b多B、a比b少C、a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题: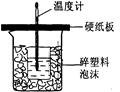
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间满碎塑料泡沫的作用是______________________________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小”、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,溶液温度升高度数________(填“相等”或“不相等”)。所求中和热的数值会________(填“相等”或“不相等”),理由是。
用惰性电极电解饱和NaCl溶液,请写出:
(1)阳极电极反应式:;总反应式:。
(2)要使电解后的溶液恢复到和原溶液一样,则应加入一定量的。
(3)已知298K时下述反应的有关数据:C(s)+1/2 O2(g)=CO(g)△H1 = -110.5kJ/mol,C(s)+O2 (g)=CO2(g), △H 2= -393.5kJ/mol ,则C(s)+CO2(g)="2CO(g)" 的△H为
【化学—选修5有机化学基础】
脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下: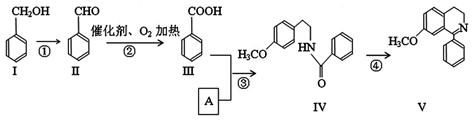
(1)Ⅱ中含氧官能团的名称。
(2)反应②的化学方程式。
(3)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式。
(4)下列说法正确的是。
| A.Ⅰ和Ⅴ均属于芳香烃 | B.Ⅱ能发生银镜反应 |
| C.Ⅱ能与4molH2发生加成反应 | D.反应③属于酯化反应 |
(5)A的结构简式。
(6)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式。
(7)一定条件下,化合物Ⅶ(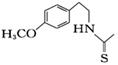 )也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式。
)也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式。
【化学—选修3物质结构与性质】
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。 E、F都是第四周期元素,
E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有
1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号,该能层具有的原子轨道数为。
(2)E2+离子的价层电子排布图是,F原子的电子排布式是。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为,B元素的气态氢化物的VSEPR模型为。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为。
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d=g/cm3。(保留两位小数)