(8分)某同学用铅蓄电池作电源,用石墨做电极电解500 mL某浓度的CuSO4溶液,观察到A电极表面有红色固体物质生成,当溶液中原有溶质完全电解后,停止通电,取出A电极,洗涤、干燥、称量,电极增重1.6 g。已知铅蓄电池的工作原理为:
Pb+PbO2+2H2SO4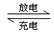 2PbSO4+2H2O
2PbSO4+2H2O
请按要求回答下列问题:
(1)电解CuSO4溶液的化学方程式 ,
(2)当反应过程中转移的电子为0.02mol时,铅蓄电池内消耗硫酸的物质的量为 mol。
(3)电解前CuSO4溶液的物质的量浓度为 。
(4)若电解前后溶液的体积不变,电解后溶液的pH=
(5)写出铅蓄电池负极的电极反应式:
“恒重”操作的目的是_________________________________________________;
判断“恒重”的依据是_________________________________________________。
(本题共10分)
测定硫酸铜晶体(CuSO4∙XH2O )中X值的实验过程如下:
41.下列是实验中用到的几种仪器,仪器与对应名称正确的是___________。
“镁带中镁的质量分数测定”中,读取量气管的读数时,要使装置内外压强保持一致,具体操作为。
在“镁带中镁的质量分数测定装置”中,导管a的作用是______________________。
若用“化学反应气体体积测定仪”也可以测定1mol二氧化碳气体的体积,那么储液瓶中应盛放________________________溶液。