某种发动机燃料由A、B两种物质混合而成,A、B两种物质含有C、H、O三种元素中的两种或三种。已知常温下A、B及CO、H2的燃烧热如下:
| 物 质 |
A |
B |
CO |
H2 |
| 燃烧热/kJ·mol-1 |
725 |
5518 |
283 |
286 |
A、B按不同比例混合的燃料91.2g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如右图。
(1)A、B的相对分子质量为A________,B_______。
(2)等物质的量的A、B混合的燃料73g,在160LO2中完全燃烧,得到104L气体,通过碱石灰吸收后剩余3.2L(气体体积均在标准状况下测定)。由此可推得混合物中N(C)∶N(H)∶N(O)=_____________________,A分子式为__________________,B分子式为__________________。
(3)1mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980kJ,则反应中生成CO________ mol。
下图中A、B、C、D、E、F、G均为有机化合物。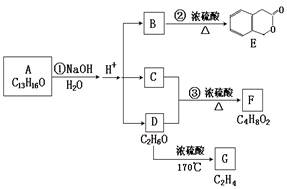
(1)写出反应②的化学反应方程式 。
(2)A的结构简式是 ,反应①的反应类型是
(3)符合下列三个条件的B的同分异构体的数目有 个。
①含有邻二取代苯环结构;②与B具有相同的官能团;
③不可与FeCl3溶液发生显色反应
(4)写出D→G反应方程式
(1)写出下列反应的离子方程:
①在NaOH溶液通入少量二氧化碳:。
②向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性:。
(2)软锰矿(MnO2)和过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,写出软锰矿制备K2MnO4的化学方程式,并标出电子转移的方向和数目:
下面是某同学研究氯气性质过程中的一个片断。请你帮助他完成部分实验并补全实验记录。
[观察]氯气的颜色、状态:色状态;闻氯气的气味:气味。
[预测]氯气是一种非金属单质,它可能具有性质有。
从元素化合价的角度分析,它可能具有性质有。
[实验探究]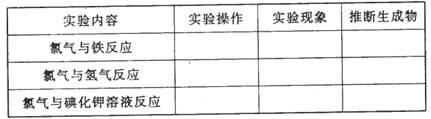
[实验结论]
(1)通过比较氯气和曾经学习过的氧气等非金属单质的性质,可推知氯气的化学性,能与反应。
(2)在上述过程中,该同学都用到了哪些研究物质性质的方法?
。
(3)说明闻气体气味的方法。。
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,反应
2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K=,SO2的平衡转化率=。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K=,SO2的平衡转化率=。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有(填字母)
| A.升高温度 | B.降低温度 | C.增大压强 |
| D.减小压强 (E)加入催化剂 (G)移出氧气 |
(3)SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为________________________________________________________________。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是______________________。
微生物燃料电池(MFC)是燃料电池中特殊的一类,它利用微生物作为反应主体,将有机物的化学能转化为电能。以葡萄糖溶液作底物为例,其工 作原理如右图所示。
作原理如右图所示。
 已知石墨电极上反应为:
已知石墨电极上反应为:
C6H12O6+6H2O-24e- 6CO2+24H+
⑴ 电池中的质子交换膜只允许质子和水分子通过。电池工作时,质子移向电源的极,铂碳上所发生的电极反应式为_____________。
⑵燃烧热是指1摩尔物质完全燃烧生成稳定的物质(如H转化为液态水,C转化为二氧化碳 )所放出的热量。葡萄糖的燃烧热为2800kJ/mol,写出葡萄糖燃烧的热化学方程式。
⑶ 化学需氧量(COD)是重要的水质指标,其数值表示将1L水中的有机物氧化为CO2、H2O所需消耗的氧气的质量。科学家设想利用微生物燃料电池来处理某些污水,并进行发电,该设想已经在实验室中获得成功。但如果1L废水中有机物(折算成葡萄糖)氧化提供的化学能低于5.6kJ,就没有发电的必要。则下列污水中,不适合用微生物燃料电池发电的是(填序号)。
| 序号 |
A |
B |
C |
D |
E |
| 污水类型 |
生活污水 |
印染 |
电镀 |
造纸 |
硫酸工业废水 |
| COD值(mg/L) |
520 |
870 |
20 |
960 |
120 |