下列离子方程式书写正确的是 ( )
A.NaHCO3溶液中加入少量NaHSO4溶液:HCO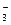 +HSO +HSO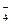 =SO =SO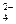 +H2O +H2O |
B.Ca(HCO3)2溶液中辊入少量Ca(OH)2溶液:Ca2++OH-+HCO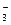 =CaCO3↓+H2O =CaCO3↓+H2O |
C.金属铝溶于氧化钠溶液:2Al+6OH-=2AlO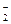 +3H2↑ +3H2↑ |
| D.Fel2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3+=2Cl- |
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)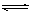 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
B.将容器体积变为20L,Z的平衡浓度变为原来的 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g) 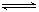 2SO3(g)ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g)ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
| A.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| B.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
下列事实不能用勒夏特列原理来解释的是
| A.加压有利于SO2与O2反应生成SO3 |
| B.温度过高对合成氨反应不利 |
| C.高温及加入催化剂都能使合成氨的反应速率加快 |
| D.用过量空气煅烧硫铁矿可以提高原料的利用率 |
下图是可逆反应A+2B  2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断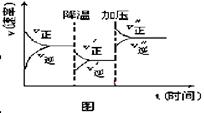
A.正反应是吸热反应
B.若A、B是气体,则D是液体或固体
C.D可能是气体.
D.A、B、C、D均为气体
已知25℃、101kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s);△H=-2834.9kJ•mol-1
②4Al(s)+2O3(g)=2Al2O3(s);△H=-3119.1kJ•mol-1由此得出的正确结论是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.反应①可确定铝的燃烧热是708.7KJ |
| C.O3比O2稳定,由O2变O3为放热反应 |
| D.反应②可确定铝的燃烧热是779.78 kJ•mol-1 |