硫酸铜晶体里结晶水的测定实验中,首先应将晶体放在___ _中研碎,晶体应在 中加热,冷却时应将其放在 中进行,如果不这样冷却则实验结果会 (填“偏高”或“偏低”或“无影响”)。此实验至少量 次。
已知溴乙烷跟氰化钠反应后再水解可以得到丙酸:
CH3CH2Br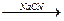 CH3CH2CN
CH3CH2CN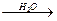 CH3CH2COOH
CH3CH2COOH
产物分子比原化合物分子多了一个碳原子,增长了碳链。请根据右边框图回答问题: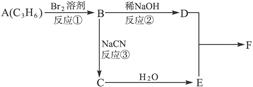
F分子中含有8个原子组成的环状结构。
(1)反应①②③中属于取代反应的是___________(填反应代号)。
(2)写出结构简式:E___________,F___________。
药物菲那西汀的一种合成路线如下:
反应②中生成的无机物的化学式是___________________。
反应③中生成的无机物的化学式是___________________。
反应⑤的化学方程式是_________________________。
菲那西汀水解的化学方程式是_____________________。
一种名为苹果醋(ACV)的浓缩饮料多年来风靡美国。ACV是一种由苹果发酵而成的酸性饮品,是具有明显药效的健康食品,解毒、降脂、减肥和止泻功能。苹果酸是这种饮料的主要酸性物质,分离提纯后的化学分析如下:
①元素分析证明该酸只含C、H、O三种元素,其中C、H、O的质量比为24∶3∶40;该酸蒸气的密度是同温同压下氢气的67倍。②0.1 mol该酸与足量NaHCO3反应放出4.48 L CO2,与足量金属钠反应放出3.36 L H2(气体体积均为标准状况下测定)。请完成下列问题:
(1)该酸的分子式为______________,结构简式为___________________。
(2)写出该酸在Cu/Ag催化剂条件下,被氧气氧化的化学反应方程式:___________________。
(3)写出该酸在一定条件下,每两个分子发生分子间脱水生成环酯的所有结构简式_______
_________。
化合物CO、HCOOH和HOOC—CHO(乙醛酸)分别燃烧时,消耗的氧气和生成的二氧化碳的体积比都是1∶2,后两者的分子式可以分别看成是(CO)(H2O)和(CO)2(H2O)。也就是说:只要分子式符合(CO)n(H2O)m( n和m均为正整数)的各种有机物,它们燃烧时消耗的氧气和生成的二氧化碳的体积比总是1∶2。
现有一些只含C、H、O三种元素的有机物,它们燃烧时消耗的氧气和生成的二氧化碳的体积比是3∶4。
(1)这些有机物中,相对分子质量最小的化合物是________。
(2)某两种碳原子数相同的上述有机物,若它们的相对分子质量分别为a和b(a>b)。则a-b必定是________(填入一个数字)的整数倍。
(3)在这些有机物中有一种化合物,它含有两个羧羟基,取0.2625 g该有机物恰好能跟25.00 mL 0.100 mol·L-1 NaOH溶液完全中和,由此可以计算得知该化合物的相对分子质量是__________________,并可推导它的分子式应为____________________。
已知溴乙烷跟氰化钠(NaCN)反应后再水解可以得到丙酸:
CH3CH2Br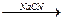 CH3CH2CN
CH3CH2CN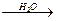 CH3CH2COOH
CH3CH2COOH
产物分子比原化合物分子多了一个碳原子,增长了碳链,请根据以下框图完成问题: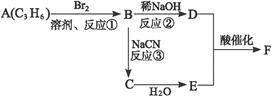
(F分子中含有8个原子组成的环状结构)
(1)反应①②③中属于取代反应的是____________(填反应代号)。
(2)写出结构简式:E.__________________________,F.___________________________。