下列推断合理的是
| A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
| C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 |
| D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
下面叙述所指的物质一定是金属单质的是( )
| A.具有金属光泽并能导电的固体 |
| B.晶体里有阳离子而没阴离子,具有延展性的固体 |
| C.单质跟碱溶液反应有氢气生成的固体 |
| D.具有显著还原性的固体 |
在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高。由此判断下列各组金属熔沸点高低顺序正确的是( )
| A.Mg>Al>Ca | B.Al>Na>Li | C.Al>Mg>Ca | D.Mg>Ba>Al |
最近发现一种钛原子和碳原子构成的气态团簇分子,如图1-13所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为()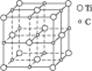
图1-13
| A.Ti14C13 | B.TiC |
| C.Ti4C4 | D.Ti4C3 |
水分子间可通过一种叫“氢键”的作用(介于化学键和范德瓦耳斯力大小之间),彼此结合而形成(H2O)n,在冰中的n值为5。即每个水分子都被其他4个水分子包围形成变形四面体,如图1-11所示为(H2O)5单元,由无限个这样的四面体通过氢键相互连接成一个庞大的分子晶体,即冰。下列有关叙述正确的是()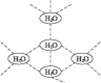
图1-11
| A.1 mol冰中有4 mol氢键 |
| B.1 mol冰中有4×5 mol氢键 |
| C.平均每个水分子只有2个氢键 |
| D.平均每个水分子只有5/4个氢键 |
共价键、离子键、分子间作用力都是粒子间的作用力,下列物质中会有以上两种作用的晶体是()
| A.SiO2 | B.Ar |
| C.NaCl | D.NaOH |