下列卤代烃在KOH醇溶液中加热不反应的是
①C6H5Cl ②(CH3)2CHCH2Cl ③(CH3)3CCH2Cl
④CHCl2CHBr2 ⑤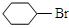
| A.①③ | B.②④ | C.②③⑤ | D.全部 |
导致下列现象的主要原因与排放SO2有关的是
| A.酸雨 | B.光化学烟雾 |
| C.臭氧空洞 | D.温室效应 |
下图是C60的分子模型、金刚石和干冰的晶体模型。请回答下列问题: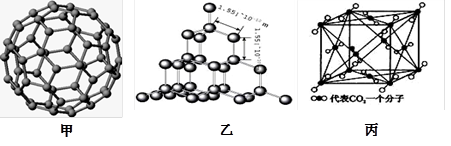
(1)硅与碳同主族,写出基态硅原子的价电子排布图______________。
(2)上述三种物质的熔点由高到低的顺序是,理由是。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是_________,1mol二氧化硅晶体中Si—O键的数目为。
(4)图丙是干冰的晶胞模型,1个CO2分子周围距离最近的CO2分子有个。
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z基态原子的2p轨道上有3个未成对电子。下列说法正确的是
| A.X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有12mol σ键 |
| B.Z的最高价含氧酸分子中,羟基氧和非羟基氧个数比为1:1 |
| C.Y的气态氢化物分子中H—Y—H键角比Y的最高价氧化物分子中O—Y—O键角小 |
| D.Z的气态氢化物比Y的气态氢化物稳定,是因为氢键的影响 |
有A、B、C、D、E五种短周期元素,A原子核外电子占据5条轨道,有两个未成对电子,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C原子核外有9种不同运动状态的电子,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个。下列说法正确的是
A.离子半径:D+ > C—
B.EA2是原子晶体
C.A和B形成的原子个数比为1:1的化合物分子是非极性分子
D.以上元素中形成的最高价氧化物对应的水化物酸性最强的是C
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是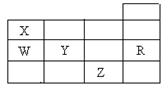
| A.常压下Z的单质沸点最高 |
| B.电负性W小于Y |
| C.W的氢化物比X的氢化物稳定 |
| D.R的单质在固态时属于原子晶体 |